วันพฤหัสบดีที่ 22 ตุลาคม พ.ศ. 2563
ข้อสอบบทที่2
ข้อสอบ หน่วยการเรียนรู้ที่ 2 พันธะเคมี
1.จำนวนพันธะโคเวเลนต์ในโมเลกุล CH4 , SiCl4 , NaCl , NH3 เป็นกี่พันธะมีค่าเรียงตามลำดับ คือข้อใด
ก. 4 , 4 , 0 , 3 ข. 6 , 3 , 1 , 0 ค. 4 , 3 , 0 , 3 ง. 5 , 4 , 1 , 0
2. พันธะเดี่ยว หมายถึงอะไร
ก. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 1 คู่
ข. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 2 คู่
ค. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 3 คู่
ง. พันธะที่เกิดจากการใช้์อิเล็กตรอนคู่โดดเดี่ยวร่วมกัน 1 คู่
3. ธาตุในข้อใด เกิดพันธะโคเวเลนต์กับธาตุคลอรีนได้ดีที่สุด
ก. Na ข. Ra ค. C ง. Cs
4. สมบัติทางกายภาพในข้อใด ที่ใช้อธิบายสมบัติทางเคมีของอโลหะ
ก. พลังงานไอออไนเซชันสูง ขนาดอะตอมใหญ่ สัมพรรคภาพอิเล็กตรอนน้อย
ข. พลังงานไอออไนเซชันต่ำ ขนาดอะตอมใหญ่ อิเล็กโทรเนกาติวิตีต่ำ
ค. พลังงานไอออไนเซชันสูง ขนาดอะตอมเล็ก สัมพรรคภาพอิเล็กตรอนน้อย
ง. พลังงานไอออไนเซชันสูง ขนาดอะตอมเล็ก อิเล็กโทรเนกาติวิตีสูง
5. ธาตุ Z มีพลังงานไอออไนเซชันตั้งแต่ลำดับที่หนึ่งถึงลำดับที่ 8 เป็นดังนี้ 1.320, 3.395, 5.307, 7.476, 10.996, 13.333, 71.343, 84.086 ธาตุ Z มีเวเลนซ์อิเล็กตรอนเท่าใด
ก. 1 ข. 4 ค. 6 ง. 7
6. ตารางแสดงค่าพลังงานพันธะเฉลี่ยในสารไฮโดรคาร์บอน
ชนิดพันธะ
พลังงานพันธะ
C - H
413
C - C
348
การสลายพันธะโพรเพน (C3H8) 0.5 โมล จะต้องใช้พลังงานมากกว่าหรือน้อยกว่าการสลายพันธะอีเทน (C2H6) 0.5 โมล เท่าไร
ก. มากกว่า 587 kJ ข. น้อยกว่า 283 kJ ค. มากกว่า 526 kJ ง. น้อยกว่า 278 kJ
7. เหตุใดสารโคเวเลนต์ จึงมีจุดเดือด จุดหลอมเหลวต่ำ
ก. สารโคเวเลนต์มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย ข. สารโคเวเลนต์มักสลายตัวได้ง่าย
ค. สารโคเวเลนต์ไม่มีประจุไฟฟ้า ง. สารโคเวเลนต์มักมีโมเลกุลขนาดเล็ก
8. สารละลายที่เกิดจากธาตุหมู่ 1 กับน้ำ มีสมบัติอย่างไร
ก. เป็นกลาง ข. เป็นได้ทั้งกรดและเบส ค. เป็นกรด ง. เป็นเบส
9. สาร X เป็นโมเลกุลไม่มีขั้ว สาร Y เป็นโมเลกุลมีขั้ว ส่วนสาร Z เป็นพันธะไม่มีขั้ว ถ้าขนาดของโมเลกุลของ X>Y>Z แล้วสาร X Y และ Z ควรเป็นดังข้อใด
ก. CH2 , NH3 , C6H6 ข. BeCl2 , CH2Cl2 , S8 ค. Br2 , H2O , H2 ง. SiH4 , PCl3 , PCl5
10. กำหนดค่า EN ของธาตุดังนี้ A = 3.0 , B = 2.8 X= 2.7 , Y = 3.7 จงเรียงลำดับความแรงขั้วจากมากไปน้อย
ก. A-B , B-X , X-Y ข. A-Y , B-X , A-X ค. Y-B , A-Y , A-X ง. A-X , B-Y , A-Y
11. ถ้า A , B และ C เป็นสารโคเวเลนต์ 3 ชนิด โดยทั้ง 3 ชนิดมีสถานะเป็นของเหลว โมเลกุลของสาร A และ B มีขั้ว ส่วนโมเลกุลของสาร C ไม่มีขั้ว สารใดสามารถละลายน้ำได้
ก. สาร C ข. สาร A และ C ค. สาร A เเละ B ง. สาร B และ C
12. จงระบุว่าสารในข้อใดละลายน้ำได้
1) แคลเซียมคลอไรด์ 2) แอมโมเนียมซัลเฟต 3 )เมอร์คิวรี(I)คลอไรด์
4) ไ อร์ออน(III)ไฮดรอกไซด์ 5) โพแทสเซียมฟอสเฟต
ก. 1 2 3 ข. 1 2 5 ค. 2 3 4 ง. 2 3 5
13. ถ้า A, B ,C ,D เป็นธาตุที่มีเลขอะตอม 7,11,17 และ 20 ตามลำดับ สูตรของไอออนและสารประกอบไอออนิกในข้อใดถูกต้อง
ข้อ
ไอออนบวก
ไอออนลบ
สูตรสารประกอบไอออนิก
ก D2+A3-D3A2
ขC3+B2-C2B3
คB+A-BA
งA+C-AC
14. X เป็นสารประกอบของธาตุ Ca และ F มีจุดหลอมเหลวสูง ไม่นำไฟฟ้าที่อุณหภูมิห้อง และละลายน้ำได้น้อยมาก ข้อสรุปใดต่อไปนี้ ไม่ สอดคล้องกับข้อมูลข้างต้น
ก. พันธะในสาร X เป็นพันธะไอออนิก
ข. เมื่อ X ละลายน้ำ จะดูดความร้อน ทำให้ละลายได้น้อย
ค. X มีสูตร CaF2 ผลึกมีความแข็งแรงมากจึงละลายได้ยาก
ง. สาร X เมื่อหลอมเหลวจะนำไฟฟ้า
15. เมื่อละลาย KCl ในน้ำเกิดปฏิกิริยาเป็นขั้น ๆ และมีการเปลี่ยนแปลงพลังงาน ดังนี้
1) KCl(s) -----> K+(g) + Cl-(aq) H1 = 701.2 kJ/mol
2) K+(g) + Cl-(g) -------> K+(aq) + Cl-(aq) H2 = 684.1 kJ/mol
ปฏิกิริยานี้เป็นแบบใด
ก. คายพลังงานเท่ากับ 1385.3 kJ/mol ข. คายพลังงานเท่ากับ 17.1 kJ/mol
ค. ดูดพลังงานเท่ากับ 17.1 kJ/mol ง. ดูดพลังงานเท่ากับ 1385.3 kJ/mol
16. สาร X , Y , Z มีพลังงานพันธะเป็น 120 , 200 , 90 kJ/mol ตามลำดับ จงเรียงความยาวพันธะจากน้อยไปมาก
ก. X , Y , Z ข. Z , Y , X ค. Y , X , Z ง. Z , X , Y
17. ข้อใดกล่าว ไม่ ถูกต้องเกี่ยวกับสมบัติของสารประกอบไอออนิก
ก. นำไฟฟ้าได้ทุกสถานะ ข. เกิดจากการรวมตัวของไอออนบวกกับไอออนลบ
ค. จัดเรียงตัวเป็นผลึก ง. มีผลรวมของประจุสุทธิ เป็น ศูนย์
18. พันธะเคมี หมายถึง อะไร
ก. แรงยึดเหนี่ยวระหว่างอะตอม ข. พลังงานที่ทำให้อะตอมสลายตัว
ค. การอยู่รวมกันของอะตอม ง. การอยู่รวมกันของโมเลกุล
19. กำหนดการจัดอิเล็กตรอนของธาตุให้ ดังนี้ A 2,8,2 B 2,8,8,1 C 2,8,7 D 2,8,18, 8 ธาตุคู่ใดมีการเกิดเป็นสารประกอบไอออนิกได้
ก. A กับ D ข. C กับ D ค. B กับ C ง. B กับ D
20. เพราะเหตุใด อโลหะจึงยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์
ก. อโลหะมีค่า EN สูงเสียอิเล็กตรอนยาก ข. อโลหะมีค่า EN สูงเสียอิเล็กตรอนง่าย
ค. อโลหะมีค่า EN ต่ำเสียอิเล็กตรอนยาก ง. อโลหะมีค่า EN ต่ำเสียอิเล็กตรอนง่าย
21. ธาตุที่เกิดพันธะไอออนิกกับออกซิเจนได้ดีที่สุด คือ ข้อใด
ก. กำมะถัน ข. คลอรีน ค. ดีบุก ง. โซเดียม
22. ข้อใดต่อไปนี้เป็นสูตรของสารประกอบ เมอร์คูริกซัลไฟด์
ก. CuCl ข. KBr ค. PbS ง. HgS
23. การเกิดสารประกอบ NaF(s) ข้อใดคือสมการรวมของปฏิกิริยา
ก. Na(g) + 1/2F2(g) ------> NaF(s)
ข. Na(s) + 2F2(g) -------> NaF(s)
ค. Na(g) + 1/2F(s) ------> NaF(s)
ง. Na(s) + 1/2F2(g) ------> NaF(s)
24. การที่อะตอมพยายามปรับตัวเองให้อยู่ในสภาพเสถียรโดยทำให้อิเล็กตรอนวงนอกสุดเท่ากับ 8 เรียกกฎนี้ว่าอะไร
ก. กฎออกซิเดชั่น ข. กฎออกเตต ค. กฎโคเวเลนต์ ง. กฎไอออนิก
25. ข้อใด ไม่ เกี่ยวข้องกับพันธะเคมี
ก. รับอิเล็กตรอนจากอะตอมอื่น ข. ใช้อิเล็กตรอนร่วมกัน
ค. แย่งอิเล็กตรอนกับอะตอมอื่น ง. ให้อิเล็กตรอนกับอะตอมอื่น
26. ข้อใดกล่าว ไม่ ถูกต้องเกี่ยวกับสมบัติของสารประกอบไอออนิก
ก. มีผลรวมของประจุสุทธิ เป็น ศูนย์ ข. เกิดจากการรวมตัวของไอออนบวกกับไอออนลบ
ค. จัดเรียงตัวเป็นผลึก ง. นำไฟฟ้าได้ทุกสถานะ
27. การที่โลหะรวมกับอโลหะแล้วโลหะจะให้อิเล็กตรอนแก่อโลหะ เกิดไอออนบวกและไอออนลบ ดึงดูดกัน ด้วยแรงดึงดูดไฟฟ้าสถิต สร้างพันธะไอออนิกขึ้นในสารประกอบนั้น เพราะเหตุใด
ก. โลหะมีขนาดอะตอมเล็กกว่าอโลหะ
ข. อโลหะมีขนาดอะตอมใหญ่กว่าโลหะ
ค. โลหะมีค่า IE ต่ำ จึงให้อิเล็กตรอนได้ง่าย เพื่อปรับเวเลนซ์อิเล็กตรอนแบบก๊าซเฉื่อย
ง. โลหะมีค่า IE สูง จึงให้อิเล็กตรอนได้ง่าย เพื่อปรับเวเลนซ์อิเล็กตรอนแบบก๊าซเฉื่อย
28. กำหนดให้
1. NaNO3 + KCl 2. NH4Cl + Ca(OH)2 3. K2SO4 + BaCl2 4. AgNO3 + KCl
5. Na2SO4 + Pb(NO3)2 6. Na2CO3 + CaCl2
การผสมสารละลายของสารประกอบไอออนิกคู่ใด ทำให้เกิดตะกอน
ก. 1 3 4 5 ข. 3 4 5 6 ค. 2 3 4 5 ง. 1 4 5 6
29. สารโคเวเลนต์ชนิดหนึ่งมีสูตร AH3 และรูปร่างโมเลกุลเป็นสามเหลี่ยมแบนราบ อะตอม A ในสารนี้ไม่มีอิเล็กตรอนคู่โดดเดี่ยว ข้อใดที่น่าจะเป็นสมบัติของสาร AH3
ก.โมเลกุลมีขั้ว ละลายน้ำ จุดเดือดต่ำ
ข.เกิดพันธะไฮโดรเจน จุดเดือดสูง และละลายน้ำได้
ค.โมเลกุลไม่มีขั้ว และมีแรงแวนเดอร์วาลส์ (ลอนดอน) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล
ง.โมเลกุลไม่มีขั้ว แต่เกิดพันธะไฮโดรเจนได้
30. ตารางข้างล่างนี้แสดงจุดหลอมเหว จุดเดือด และความสามารถในการนำไฟฟ้า เมื่อหลอมเหลวของสารประกอบคลอไรด์ A , B และC
สารประกอบคลอไรด์
จุดหลอมเหลว
จุดเดือด
การนำไฟฟ้า
A 883 1650 ดีมาก
B 1148 2750 ดี
C 548 1005 ไม่ดี
สิ่งที่สรุปได้จากข้อมูลคือ
ก. A และ B เป็นสารประกอบไอออนิก ข. A,B และ C เป็นสารประกอบไอออนิก
ค. A เป็นสารประกอบไอออนิกเพียงสารเดียว ง. B เป็นสารประกอบไอออนิกเพียงสารเดียว
31. สารใดมีรูปร่างโมเลกุล ไม่ เหมือนกัน
ก. HO2 และ SBr2 ข. NOCl และ COS ค. HCl และ CS2 ง. CCl4และ POCl3
32. สารในข้อใด เป็นโมเลกุลมีขั้ว แต่ ไม่มี พันธะไฮโดรเจน
ก. HF ข. NH3 ค. C2H5OH ง. SO2
กำหนด พลังงานพันธะ(kJ/mol) C-C = 348 C=C = 614 C-H =413 C-Cl = 339 Cl-Cl = 242
C=O = 745 C-O = 358 O-H = 463 O=O = 498
33. ถ้าไซโคลเฮกซีน(C6H10) เกิดปฏิกิริยาการรวมตัวกับคลอรีนจะมีการเปลี่ยนแปลงพลังงานกี่กิโลจูลต่อโมล
ก. 170 ข. 340 ค. 412 ง. 242
34. ในการเผาไหม้โพรทานอล ( C3H7OH ) 1 โมล ได้ผลิตภัณฑ์เป็น แก๊ส CO2 และ H2O (ไอน้ำ) จะดูดหรือคายพลังงาน กี่กิโลจูลต่อโมล
ก. ดูดพลังงาน 1.52 kJ ข. คายพลังงาน 1,525 kJ
ค. ดูดพลังงาน 1,883 kJ ง. คายพลังงาน 1,883 kJ
35. กำหนดให้ ธาตุ A มีพลังงานไอออไนเซชันตั้งแต่ ลำดับที่ 1 ถึง 8 ดังนี้ 1.320,3.395, 5.307, 7.476, 10.996, 13.333, 71.343 และ 84.086
ธาตุ B มีพลังงานไอออไนเซชัน ตั้งแต่ลำดับที่ 1 ถึง 4 ดังนี้ 800, 2400, 3700 และ 25000
จงพิจารณาข้อความต่อไปนี้
1. สูตรทั่วไปของสารประกอบ AB คือ A2B3
2. สารประกอบ AB เมื่อละลายในน้ำแล้วเปลี่ยนกระดาษลิตมัสจากแดงเป็นน้ำเงิน แต่ไม่เปลี่ยนกระดาษลิตมัสจากน้ำเงินเป็นแดง
3. สารประกอบ AB มีจุดเดือดและจุดหลอมเหลวสูง
4. สารประกอบ AB ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์และมีลักษณะเป็นของเหลว
ข้อใดถูก
ก. 1,4 ข. 2,3 ค. ค. เฉพาะ 3 ง. เฉพาะ 4
36. ข้อมูลแสดงค่าพลังงานที่เกี่ยวข้องกับการละลายสาร A, B, และ C เป็นดังนี้
สารพลังงานไฮเดรชัน พลังงานแลตทิซ
A 745 750
B 590 550
C 690 700
ถ้าใช้สาร A, B และ C จำนวนโมลเท่ากัน ละลายในน้ำที่มีปริมาตร 100 cm3 การเปรียบเทียบอุณหภูมิของแต่ละสารละลาย ข้อใดถูก
ก. A > B > C ข. B > A > C ค. B > C > A ง. C > A > B
37. กำหนดให้ พลังงานแลตทิชของ NaCl = 787 kJ/mol พลังงานไอออไนเซชั่นของ Na(g) = 494 kJ/mol
พลังงานของ Cl2(g) = 242 kJ/mol พลังงานสัมพรรคภาพอิเล็กตรอนของ Cl(g) = 347 kJ/mol
พลังงานการระเหิดของ Na(s) = 109 kJ/mol
ปฏิกิริยา Na(s) + 1/2Cl2 ------> NaCl(s) ที่ 25 C คายพลังงานความร้อนจำนวนเท่าใด
ก. 410 kJ ข. 531 kJ ค. 724 kJ ง. 1134 kJ
38. 38Sr ทำปฎิกิริยากับ 16S สารประกอบที่ได้ควรมีสูตรอย่างไร
ก. SrS3 ข. Sr2S3 ค. SrS ง. Sr3S3
39. สูตรโครงสร้างลิวอิสตามกฏออกเตตของโมเลกุลและไอออนต่อไปนี้ ข้อใดไม่มีขั้ว
ก. OF2 ข. FNO ค. CO ง. OCS
40. อะตอมของธาตุใดที่อยู่ในสภาพที่เสถียร
ก. ฮีเลียม ข. ไนโตรเจน ค. ไฮโดรเจน ง. อาร์ซินิก
41. ข้อความใดต่อไปนี้ ไม่ ถูกต้อง
ก. พันธะโคเวเลนต์เป็นพันธะที่เกิดจากการใช้อิเล็กตรอนเป็นคู่ๆ
ข. พันธะไอออนิกเป็นแรงดึงดูดระหว่างไอออนที่มีประจุต่างกัน
ค. พันธะโลหะเป็นพันธะที่เกิดจากแรงดึงดูดระหว่างอะตอมของโลหะกับอิเล็กตรอนทั้งหมดที่มีอยู่ในโลหะ
ง. พันธะไอออนิก ทำให้สารไอออนิกไม่มีสูตรโมเลกุลและมีจุดหลอมเหลวสูง
42. อะตอมที่ให้หรือรับอิเล็คตรอน จะเกิดเป็นพันธะใด
ก. พันธะเคมี ข. พันธะไอออนิก ค. พันธะโคเวเลนต์ ง. พันธะโลหะ
43. ประเภทของพันธะหรือแรงยึดเหนี่ยวระหว่างอนุภาคในสารต่อไปนี้ เหล็ก, น้ำตาลกลูโคส, เกลือแกง ข้อใดต่อไปนี้ เป็นการเรียงลำดับอย่างถูกต้อง
ก. พันธะโลหะ , พันธะโคเวเลนต์, แรงลอนดอน ข. แรงลอนดอน, พันธะไอออนิก, พันธะโคเวเลนต์
ค. พันธะไอออนิก, พันธะโคเวเลนต์, พันธะโลหะ ง. พันธะโลหะ, แรงลอนดอน, พันธะไอออนิก
44. ข้อใดต่อไปนี้ผิด
ก. สารประกอบไอออนิกมักเกิดระหว่างธาตุที่มีพลังงานไอออไนเชชันต่ำกับธาตุที่มีค่าENสูง
ข. เมื่อหลอมเหลวสารประกอบไอออนิกจะเป็นปฏิกิริยาดูดความร้อน
ค. การเกิดสารประกอบไอออนิกเป็นปฏิกิริยาดูดความร้อน
ง. สารประกอบไอออนิกยึดเหนี่ยวกันด้วยแรงทางไฟฟ้า
45. ข้อใด ไม่ใช่ แรงยึดเหนี่ยวระหว่างโมเลกุล
ก. แรงแวนเดอร์วาลส์ ข. แรงดึงดูดระหว่างขั้ว ค. พันธะไฮโดรเจน ง. พันธะโคเวเลนต์
46. พิสูจน์ใดที่เเสดงว่าผลึกโซเดียมคลอไรด์เป็นสารประกอบไอออนิก
อนิก ก. ผลึกโซเดียมคลอไรด์ละลายน้ำ สารละลายที่ได้จะมีจุดเยือกเเข็งลดลง
ข. โซเดียมคลอไรด์ที่หลอมเหลวนำไฟฟ้าได้
ค. โซเดียมคลอไรด์ละลายน้ำเเล้วคายพลังงาน
ง. โซเดียมคลอไรด์ละลายน้ำนำไฟฟ้าได้
47. รูปร่างโมเลกุลของสารในข้อใดเป็นรูปสามเหลี่ยมแบนราบ
ก. NH4+ และ SiH4 ข. SO3 และ BF3 ค. CH3Cl และ O3 ง. PH3 และ CH2O
48. ธาตุ A และ B มีเลขอะตอม 15 และ 35 ตามลำดับ คลอไรด์ของ A และ B ควรมีรูปร่างอย่างไร ตามลำดับ
ก. สามเหลี่ยมแบนราบ และพีระมิดฐานสามเหลี่ยม ข. พีระมิดฐานสามเหลี่ยม และเส้นตรง
ค. ทรงสี่หน้า และสามเหลี่ยมแบนราบ ง. พีระมิดคู่ฐานสามเหลี่ยม และเส้นตรง
49. มุมระหว่างพันธะในโมเลกุลโคเวเลนต์เรียงตามลำดับจากมากไปน้อยดังข้อใด
ก. CS2 > BF3 > CH4 > Cl2O ข. Cl2O > CS2 > BF3 > CH4
ค. BF3 > CS2 > Cl2O > CH4 ง. CS2 > Cl2O > BF3 > CH4
50. ข้อใดเป็นโมเลกุล ไม่มีขั้ว
ก. CO2, CCl4 และ CH3Cl ข. CO2, SF6 และ BCl3
ค. BCl3, NCl3 และ CCl4 ง. HCN, NCl3 และ CO2
เฉลยง้าบบบ
ก. 4 , 4 , 0 , 3 ข. 6 , 3 , 1 , 0 ค. 4 , 3 , 0 , 3 ง. 5 , 4 , 1 , 0
2. พันธะเดี่ยว หมายถึงอะไร
ก. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 1 คู่
ข. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 2 คู่
ค. พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 3 คู่
ง. พันธะที่เกิดจากการใช้์อิเล็กตรอนคู่โดดเดี่ยวร่วมกัน 1 คู่
3. ธาตุในข้อใด เกิดพันธะโคเวเลนต์กับธาตุคลอรีนได้ดีที่สุด
ก. Na ข. Ra ค. C ง. Cs
4. สมบัติทางกายภาพในข้อใด ที่ใช้อธิบายสมบัติทางเคมีของอโลหะ
ก. พลังงานไอออไนเซชันสูง ขนาดอะตอมใหญ่ สัมพรรคภาพอิเล็กตรอนน้อย
ข. พลังงานไอออไนเซชันต่ำ ขนาดอะตอมใหญ่ อิเล็กโทรเนกาติวิตีต่ำ
ค. พลังงานไอออไนเซชันสูง ขนาดอะตอมเล็ก สัมพรรคภาพอิเล็กตรอนน้อย
ง. พลังงานไอออไนเซชันสูง ขนาดอะตอมเล็ก อิเล็กโทรเนกาติวิตีสูง
5. ธาตุ Z มีพลังงานไอออไนเซชันตั้งแต่ลำดับที่หนึ่งถึงลำดับที่ 8 เป็นดังนี้ 1.320, 3.395, 5.307, 7.476, 10.996, 13.333, 71.343, 84.086 ธาตุ Z มีเวเลนซ์อิเล็กตรอนเท่าใด
ก. 1 ข. 4 ค. 6 ง. 7
6. ตารางแสดงค่าพลังงานพันธะเฉลี่ยในสารไฮโดรคาร์บอน
ชนิดพันธะ
พลังงานพันธะ
C - H
413
C - C
348
การสลายพันธะโพรเพน (C3H8) 0.5 โมล จะต้องใช้พลังงานมากกว่าหรือน้อยกว่าการสลายพันธะอีเทน (C2H6) 0.5 โมล เท่าไร
ก. มากกว่า 587 kJ ข. น้อยกว่า 283 kJ ค. มากกว่า 526 kJ ง. น้อยกว่า 278 kJ
7. เหตุใดสารโคเวเลนต์ จึงมีจุดเดือด จุดหลอมเหลวต่ำ
ก. สารโคเวเลนต์มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย ข. สารโคเวเลนต์มักสลายตัวได้ง่าย
ค. สารโคเวเลนต์ไม่มีประจุไฟฟ้า ง. สารโคเวเลนต์มักมีโมเลกุลขนาดเล็ก
8. สารละลายที่เกิดจากธาตุหมู่ 1 กับน้ำ มีสมบัติอย่างไร
ก. เป็นกลาง ข. เป็นได้ทั้งกรดและเบส ค. เป็นกรด ง. เป็นเบส
9. สาร X เป็นโมเลกุลไม่มีขั้ว สาร Y เป็นโมเลกุลมีขั้ว ส่วนสาร Z เป็นพันธะไม่มีขั้ว ถ้าขนาดของโมเลกุลของ X>Y>Z แล้วสาร X Y และ Z ควรเป็นดังข้อใด
ก. CH2 , NH3 , C6H6 ข. BeCl2 , CH2Cl2 , S8 ค. Br2 , H2O , H2 ง. SiH4 , PCl3 , PCl5
10. กำหนดค่า EN ของธาตุดังนี้ A = 3.0 , B = 2.8 X= 2.7 , Y = 3.7 จงเรียงลำดับความแรงขั้วจากมากไปน้อย
ก. A-B , B-X , X-Y ข. A-Y , B-X , A-X ค. Y-B , A-Y , A-X ง. A-X , B-Y , A-Y
11. ถ้า A , B และ C เป็นสารโคเวเลนต์ 3 ชนิด โดยทั้ง 3 ชนิดมีสถานะเป็นของเหลว โมเลกุลของสาร A และ B มีขั้ว ส่วนโมเลกุลของสาร C ไม่มีขั้ว สารใดสามารถละลายน้ำได้
ก. สาร C ข. สาร A และ C ค. สาร A เเละ B ง. สาร B และ C
12. จงระบุว่าสารในข้อใดละลายน้ำได้
1) แคลเซียมคลอไรด์ 2) แอมโมเนียมซัลเฟต 3 )เมอร์คิวรี(I)คลอไรด์
4) ไ อร์ออน(III)ไฮดรอกไซด์ 5) โพแทสเซียมฟอสเฟต
ก. 1 2 3 ข. 1 2 5 ค. 2 3 4 ง. 2 3 5
13. ถ้า A, B ,C ,D เป็นธาตุที่มีเลขอะตอม 7,11,17 และ 20 ตามลำดับ สูตรของไอออนและสารประกอบไอออนิกในข้อใดถูกต้อง
ข้อ
ไอออนบวก
ไอออนลบ
สูตรสารประกอบไอออนิก
ก D2+A3-D3A2
ขC3+B2-C2B3
คB+A-BA
งA+C-AC
14. X เป็นสารประกอบของธาตุ Ca และ F มีจุดหลอมเหลวสูง ไม่นำไฟฟ้าที่อุณหภูมิห้อง และละลายน้ำได้น้อยมาก ข้อสรุปใดต่อไปนี้ ไม่ สอดคล้องกับข้อมูลข้างต้น
ก. พันธะในสาร X เป็นพันธะไอออนิก
ข. เมื่อ X ละลายน้ำ จะดูดความร้อน ทำให้ละลายได้น้อย
ค. X มีสูตร CaF2 ผลึกมีความแข็งแรงมากจึงละลายได้ยาก
ง. สาร X เมื่อหลอมเหลวจะนำไฟฟ้า
15. เมื่อละลาย KCl ในน้ำเกิดปฏิกิริยาเป็นขั้น ๆ และมีการเปลี่ยนแปลงพลังงาน ดังนี้
1) KCl(s) -----> K+(g) + Cl-(aq) H1 = 701.2 kJ/mol
2) K+(g) + Cl-(g) -------> K+(aq) + Cl-(aq) H2 = 684.1 kJ/mol
ปฏิกิริยานี้เป็นแบบใด
ก. คายพลังงานเท่ากับ 1385.3 kJ/mol ข. คายพลังงานเท่ากับ 17.1 kJ/mol
ค. ดูดพลังงานเท่ากับ 17.1 kJ/mol ง. ดูดพลังงานเท่ากับ 1385.3 kJ/mol
16. สาร X , Y , Z มีพลังงานพันธะเป็น 120 , 200 , 90 kJ/mol ตามลำดับ จงเรียงความยาวพันธะจากน้อยไปมาก
ก. X , Y , Z ข. Z , Y , X ค. Y , X , Z ง. Z , X , Y
17. ข้อใดกล่าว ไม่ ถูกต้องเกี่ยวกับสมบัติของสารประกอบไอออนิก
ก. นำไฟฟ้าได้ทุกสถานะ ข. เกิดจากการรวมตัวของไอออนบวกกับไอออนลบ
ค. จัดเรียงตัวเป็นผลึก ง. มีผลรวมของประจุสุทธิ เป็น ศูนย์
18. พันธะเคมี หมายถึง อะไร
ก. แรงยึดเหนี่ยวระหว่างอะตอม ข. พลังงานที่ทำให้อะตอมสลายตัว
ค. การอยู่รวมกันของอะตอม ง. การอยู่รวมกันของโมเลกุล
19. กำหนดการจัดอิเล็กตรอนของธาตุให้ ดังนี้ A 2,8,2 B 2,8,8,1 C 2,8,7 D 2,8,18, 8 ธาตุคู่ใดมีการเกิดเป็นสารประกอบไอออนิกได้
ก. A กับ D ข. C กับ D ค. B กับ C ง. B กับ D
20. เพราะเหตุใด อโลหะจึงยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์
ก. อโลหะมีค่า EN สูงเสียอิเล็กตรอนยาก ข. อโลหะมีค่า EN สูงเสียอิเล็กตรอนง่าย
ค. อโลหะมีค่า EN ต่ำเสียอิเล็กตรอนยาก ง. อโลหะมีค่า EN ต่ำเสียอิเล็กตรอนง่าย
21. ธาตุที่เกิดพันธะไอออนิกกับออกซิเจนได้ดีที่สุด คือ ข้อใด
ก. กำมะถัน ข. คลอรีน ค. ดีบุก ง. โซเดียม
22. ข้อใดต่อไปนี้เป็นสูตรของสารประกอบ เมอร์คูริกซัลไฟด์
ก. CuCl ข. KBr ค. PbS ง. HgS
23. การเกิดสารประกอบ NaF(s) ข้อใดคือสมการรวมของปฏิกิริยา
ก. Na(g) + 1/2F2(g) ------> NaF(s)
ข. Na(s) + 2F2(g) -------> NaF(s)
ค. Na(g) + 1/2F(s) ------> NaF(s)
ง. Na(s) + 1/2F2(g) ------> NaF(s)
24. การที่อะตอมพยายามปรับตัวเองให้อยู่ในสภาพเสถียรโดยทำให้อิเล็กตรอนวงนอกสุดเท่ากับ 8 เรียกกฎนี้ว่าอะไร
ก. กฎออกซิเดชั่น ข. กฎออกเตต ค. กฎโคเวเลนต์ ง. กฎไอออนิก
25. ข้อใด ไม่ เกี่ยวข้องกับพันธะเคมี
ก. รับอิเล็กตรอนจากอะตอมอื่น ข. ใช้อิเล็กตรอนร่วมกัน
ค. แย่งอิเล็กตรอนกับอะตอมอื่น ง. ให้อิเล็กตรอนกับอะตอมอื่น
26. ข้อใดกล่าว ไม่ ถูกต้องเกี่ยวกับสมบัติของสารประกอบไอออนิก
ก. มีผลรวมของประจุสุทธิ เป็น ศูนย์ ข. เกิดจากการรวมตัวของไอออนบวกกับไอออนลบ
ค. จัดเรียงตัวเป็นผลึก ง. นำไฟฟ้าได้ทุกสถานะ
27. การที่โลหะรวมกับอโลหะแล้วโลหะจะให้อิเล็กตรอนแก่อโลหะ เกิดไอออนบวกและไอออนลบ ดึงดูดกัน ด้วยแรงดึงดูดไฟฟ้าสถิต สร้างพันธะไอออนิกขึ้นในสารประกอบนั้น เพราะเหตุใด
ก. โลหะมีขนาดอะตอมเล็กกว่าอโลหะ
ข. อโลหะมีขนาดอะตอมใหญ่กว่าโลหะ
ค. โลหะมีค่า IE ต่ำ จึงให้อิเล็กตรอนได้ง่าย เพื่อปรับเวเลนซ์อิเล็กตรอนแบบก๊าซเฉื่อย
ง. โลหะมีค่า IE สูง จึงให้อิเล็กตรอนได้ง่าย เพื่อปรับเวเลนซ์อิเล็กตรอนแบบก๊าซเฉื่อย
28. กำหนดให้
1. NaNO3 + KCl 2. NH4Cl + Ca(OH)2 3. K2SO4 + BaCl2 4. AgNO3 + KCl
5. Na2SO4 + Pb(NO3)2 6. Na2CO3 + CaCl2
การผสมสารละลายของสารประกอบไอออนิกคู่ใด ทำให้เกิดตะกอน
ก. 1 3 4 5 ข. 3 4 5 6 ค. 2 3 4 5 ง. 1 4 5 6
29. สารโคเวเลนต์ชนิดหนึ่งมีสูตร AH3 และรูปร่างโมเลกุลเป็นสามเหลี่ยมแบนราบ อะตอม A ในสารนี้ไม่มีอิเล็กตรอนคู่โดดเดี่ยว ข้อใดที่น่าจะเป็นสมบัติของสาร AH3
ก.โมเลกุลมีขั้ว ละลายน้ำ จุดเดือดต่ำ
ข.เกิดพันธะไฮโดรเจน จุดเดือดสูง และละลายน้ำได้
ค.โมเลกุลไม่มีขั้ว และมีแรงแวนเดอร์วาลส์ (ลอนดอน) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล
ง.โมเลกุลไม่มีขั้ว แต่เกิดพันธะไฮโดรเจนได้
30. ตารางข้างล่างนี้แสดงจุดหลอมเหว จุดเดือด และความสามารถในการนำไฟฟ้า เมื่อหลอมเหลวของสารประกอบคลอไรด์ A , B และC
สารประกอบคลอไรด์
จุดหลอมเหลว
จุดเดือด
การนำไฟฟ้า
A 883 1650 ดีมาก
B 1148 2750 ดี
C 548 1005 ไม่ดี
สิ่งที่สรุปได้จากข้อมูลคือ
ก. A และ B เป็นสารประกอบไอออนิก ข. A,B และ C เป็นสารประกอบไอออนิก
ค. A เป็นสารประกอบไอออนิกเพียงสารเดียว ง. B เป็นสารประกอบไอออนิกเพียงสารเดียว
31. สารใดมีรูปร่างโมเลกุล ไม่ เหมือนกัน
ก. HO2 และ SBr2 ข. NOCl และ COS ค. HCl และ CS2 ง. CCl4และ POCl3
32. สารในข้อใด เป็นโมเลกุลมีขั้ว แต่ ไม่มี พันธะไฮโดรเจน
ก. HF ข. NH3 ค. C2H5OH ง. SO2
กำหนด พลังงานพันธะ(kJ/mol) C-C = 348 C=C = 614 C-H =413 C-Cl = 339 Cl-Cl = 242
C=O = 745 C-O = 358 O-H = 463 O=O = 498
33. ถ้าไซโคลเฮกซีน(C6H10) เกิดปฏิกิริยาการรวมตัวกับคลอรีนจะมีการเปลี่ยนแปลงพลังงานกี่กิโลจูลต่อโมล
ก. 170 ข. 340 ค. 412 ง. 242
34. ในการเผาไหม้โพรทานอล ( C3H7OH ) 1 โมล ได้ผลิตภัณฑ์เป็น แก๊ส CO2 และ H2O (ไอน้ำ) จะดูดหรือคายพลังงาน กี่กิโลจูลต่อโมล
ก. ดูดพลังงาน 1.52 kJ ข. คายพลังงาน 1,525 kJ
ค. ดูดพลังงาน 1,883 kJ ง. คายพลังงาน 1,883 kJ
35. กำหนดให้ ธาตุ A มีพลังงานไอออไนเซชันตั้งแต่ ลำดับที่ 1 ถึง 8 ดังนี้ 1.320,3.395, 5.307, 7.476, 10.996, 13.333, 71.343 และ 84.086
ธาตุ B มีพลังงานไอออไนเซชัน ตั้งแต่ลำดับที่ 1 ถึง 4 ดังนี้ 800, 2400, 3700 และ 25000
จงพิจารณาข้อความต่อไปนี้
1. สูตรทั่วไปของสารประกอบ AB คือ A2B3
2. สารประกอบ AB เมื่อละลายในน้ำแล้วเปลี่ยนกระดาษลิตมัสจากแดงเป็นน้ำเงิน แต่ไม่เปลี่ยนกระดาษลิตมัสจากน้ำเงินเป็นแดง
3. สารประกอบ AB มีจุดเดือดและจุดหลอมเหลวสูง
4. สารประกอบ AB ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์และมีลักษณะเป็นของเหลว
ข้อใดถูก
ก. 1,4 ข. 2,3 ค. ค. เฉพาะ 3 ง. เฉพาะ 4
36. ข้อมูลแสดงค่าพลังงานที่เกี่ยวข้องกับการละลายสาร A, B, และ C เป็นดังนี้
สารพลังงานไฮเดรชัน พลังงานแลตทิซ
A 745 750
B 590 550
C 690 700
ถ้าใช้สาร A, B และ C จำนวนโมลเท่ากัน ละลายในน้ำที่มีปริมาตร 100 cm3 การเปรียบเทียบอุณหภูมิของแต่ละสารละลาย ข้อใดถูก
ก. A > B > C ข. B > A > C ค. B > C > A ง. C > A > B
37. กำหนดให้ พลังงานแลตทิชของ NaCl = 787 kJ/mol พลังงานไอออไนเซชั่นของ Na(g) = 494 kJ/mol
พลังงานของ Cl2(g) = 242 kJ/mol พลังงานสัมพรรคภาพอิเล็กตรอนของ Cl(g) = 347 kJ/mol
พลังงานการระเหิดของ Na(s) = 109 kJ/mol
ปฏิกิริยา Na(s) + 1/2Cl2 ------> NaCl(s) ที่ 25 C คายพลังงานความร้อนจำนวนเท่าใด
ก. 410 kJ ข. 531 kJ ค. 724 kJ ง. 1134 kJ
38. 38Sr ทำปฎิกิริยากับ 16S สารประกอบที่ได้ควรมีสูตรอย่างไร
ก. SrS3 ข. Sr2S3 ค. SrS ง. Sr3S3
39. สูตรโครงสร้างลิวอิสตามกฏออกเตตของโมเลกุลและไอออนต่อไปนี้ ข้อใดไม่มีขั้ว
ก. OF2 ข. FNO ค. CO ง. OCS
40. อะตอมของธาตุใดที่อยู่ในสภาพที่เสถียร
ก. ฮีเลียม ข. ไนโตรเจน ค. ไฮโดรเจน ง. อาร์ซินิก
41. ข้อความใดต่อไปนี้ ไม่ ถูกต้อง
ก. พันธะโคเวเลนต์เป็นพันธะที่เกิดจากการใช้อิเล็กตรอนเป็นคู่ๆ
ข. พันธะไอออนิกเป็นแรงดึงดูดระหว่างไอออนที่มีประจุต่างกัน
ค. พันธะโลหะเป็นพันธะที่เกิดจากแรงดึงดูดระหว่างอะตอมของโลหะกับอิเล็กตรอนทั้งหมดที่มีอยู่ในโลหะ
ง. พันธะไอออนิก ทำให้สารไอออนิกไม่มีสูตรโมเลกุลและมีจุดหลอมเหลวสูง
42. อะตอมที่ให้หรือรับอิเล็คตรอน จะเกิดเป็นพันธะใด
ก. พันธะเคมี ข. พันธะไอออนิก ค. พันธะโคเวเลนต์ ง. พันธะโลหะ
43. ประเภทของพันธะหรือแรงยึดเหนี่ยวระหว่างอนุภาคในสารต่อไปนี้ เหล็ก, น้ำตาลกลูโคส, เกลือแกง ข้อใดต่อไปนี้ เป็นการเรียงลำดับอย่างถูกต้อง
ก. พันธะโลหะ , พันธะโคเวเลนต์, แรงลอนดอน ข. แรงลอนดอน, พันธะไอออนิก, พันธะโคเวเลนต์
ค. พันธะไอออนิก, พันธะโคเวเลนต์, พันธะโลหะ ง. พันธะโลหะ, แรงลอนดอน, พันธะไอออนิก
44. ข้อใดต่อไปนี้ผิด
ก. สารประกอบไอออนิกมักเกิดระหว่างธาตุที่มีพลังงานไอออไนเชชันต่ำกับธาตุที่มีค่าENสูง
ข. เมื่อหลอมเหลวสารประกอบไอออนิกจะเป็นปฏิกิริยาดูดความร้อน
ค. การเกิดสารประกอบไอออนิกเป็นปฏิกิริยาดูดความร้อน
ง. สารประกอบไอออนิกยึดเหนี่ยวกันด้วยแรงทางไฟฟ้า
45. ข้อใด ไม่ใช่ แรงยึดเหนี่ยวระหว่างโมเลกุล
ก. แรงแวนเดอร์วาลส์ ข. แรงดึงดูดระหว่างขั้ว ค. พันธะไฮโดรเจน ง. พันธะโคเวเลนต์
46. พิสูจน์ใดที่เเสดงว่าผลึกโซเดียมคลอไรด์เป็นสารประกอบไอออนิก
อนิก ก. ผลึกโซเดียมคลอไรด์ละลายน้ำ สารละลายที่ได้จะมีจุดเยือกเเข็งลดลง
ข. โซเดียมคลอไรด์ที่หลอมเหลวนำไฟฟ้าได้
ค. โซเดียมคลอไรด์ละลายน้ำเเล้วคายพลังงาน
ง. โซเดียมคลอไรด์ละลายน้ำนำไฟฟ้าได้
47. รูปร่างโมเลกุลของสารในข้อใดเป็นรูปสามเหลี่ยมแบนราบ
ก. NH4+ และ SiH4 ข. SO3 และ BF3 ค. CH3Cl และ O3 ง. PH3 และ CH2O
48. ธาตุ A และ B มีเลขอะตอม 15 และ 35 ตามลำดับ คลอไรด์ของ A และ B ควรมีรูปร่างอย่างไร ตามลำดับ
ก. สามเหลี่ยมแบนราบ และพีระมิดฐานสามเหลี่ยม ข. พีระมิดฐานสามเหลี่ยม และเส้นตรง
ค. ทรงสี่หน้า และสามเหลี่ยมแบนราบ ง. พีระมิดคู่ฐานสามเหลี่ยม และเส้นตรง
49. มุมระหว่างพันธะในโมเลกุลโคเวเลนต์เรียงตามลำดับจากมากไปน้อยดังข้อใด
ก. CS2 > BF3 > CH4 > Cl2O ข. Cl2O > CS2 > BF3 > CH4
ค. BF3 > CS2 > Cl2O > CH4 ง. CS2 > Cl2O > BF3 > CH4
50. ข้อใดเป็นโมเลกุล ไม่มีขั้ว
ก. CO2, CCl4 และ CH3Cl ข. CO2, SF6 และ BCl3
ค. BCl3, NCl3 และ CCl4 ง. HCN, NCl3 และ CO2
เฉลยง้าบบบ
1. ก
2. ก
3. ค
4. ง
5. ค
6. ก
7. ก
8. ง
9. ค
10. ค
11. ค
12. ข
13. ก
14. ข
15. ค
16. ค
17. ก
18. ก
19. ค
20. ก
21. ง
22. ง
23. ง
24. ข
25. ค
26. ง
27. ค
28. ข
29. ค
30. ก
31. ข
32. ง
33. ก
34. ข
35. ค
36. ค
37. ก
38. ค
39. ก
40. ก
41. ค
42. ข
43. ง
44. ค
45. ง
46. ข
47. ข
48. ข
49. ก
50. ข
ข้อสอบ หน่วยการเรียนรู้ที่ 1 อะตอมและตารางธาตุ
แบบทดสอบ หน่วยการเรียนรู้ที่ 1 อะตอมและตารางธาตุ
1. อะตอมประกอบไปด้วยโปรตอนและอิเล็กตรอนในจำนวนที่เท่า ๆ กัน คือ แบบจำลองอะตอมของใคร
ก. ดอลตัน
ข. ทอมสัน
ค. รัทเทอร์ฟอร์ด
ง. โบร์
2. ข้อใดกล่าวถูกต้อง
ก. ธาตุต่างชนิดกันมีมวลต่างกันหรือมีนิวตรอนต่างกันเรียกว่าไอโซโทป
ข. มวลของอะตอม คือ มวลของโปรตอนกับอิเล็กตรอนในนิวเคลียส
ค. มวลของอะตอม คือ มวลของโปรตอนกับนิวตรอนในนิวเคลียส
ง. เลขอะตอมจะบอกถึงจำนวนโปรตอนและจำนวนนิวตรอนในอะตอม
3. อนุภาคข้อใดที่มีมวลใกล้เคียงกัน
ก. โปรตอน อิเล็กตรอน และนิวตรอน
ข. โปรตอนกับอิเล็กตรอน
ค. นิวครอนกับอิเล็กตรอน
ง. โปรตอนกับนิวตรอน
4. ข้อใดถูกต้องเกี่ยวกับแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
ก. โปรตอนและอิเล็กตรอนรวมกันเป็นนิวเคลียสของอะตอม
ข.นิวเคลียสมีขนาดเล็กมากและมีมวลมากภายในประกอบด้วยอนุภาคโปรตอน
ค. นิวเคลียสเป็นกลางทางไฟฟ้าเพราะประจุของโปรตอนกับของอิเล็กตรอนเท่ากัน
ง. อะตอมของธาตุประกอบด้วยอนุภาคโปรตอนและอิเล็กตรอนกระจัดกระจายอยู่ภายในด้วยจำนวนเท่ากัน
5. เลขอะตอมของธาตุ คือข้อใด
ก. จำนวนอิเล็กตรอนในอะตอมของธาตุ
ข. จำนวนโปรตอนในอะตอมของธาตุ
ค. จำนวนนิวครอนในอะตอมของธาตุ
ง. จำนวนโปรตอนกับนิวตรอนในอะตอมของธาตุ
ก. 31, 15, 15
ข. 31, 16, 15
ค. 16, 15, 15
ง. 15, 31, 16
7. ข้อใดอธิบายความหมายไอโซโทปของธาตุได้ถูกต้อง
ก. ธาตุชนิดเดียวกัน เลขมวลเหมือนกันแต่เลขอะตอมต่างกัน
ข. ธาตุชนิดเดียวกันมีประจุในนิวเคลียสเหมือนกันแต่เลขมวลต่างกัน
ค. ธาตุต่างชนิดกันมีเลขอะตอมเหมือนกันแต่เลขมวลต่างกัน
ง. ธาตุต่างชนิดกันมีประจุในนิวเคลียสเหมือนกันแต่เลขมวลต่างกัน
8. ธาตุโซเดียม (Na) มีเลขอะตอมเท่ากับ 11 จะมีการจัดเรียงอิเล็กตรอนดังข้อใด
ข. 2, 8, 1
ค. 2, 6, 5
ง. 1, 8, 2
9. ข้อใดบอกความหมายของเลขมวลได้ถูกต้อง
ก. จำนวนโปรตอนในนิวเคลียสของอะตอม
ข. มวลรวมของนิวตรอนโปรตอน และอิเล็กตรอนในอะตอม
ค. มวลรวมของนิวตรอนและโปรตอนในนิวเคลียสของอะตอม
ง. มวลรวมของโปรตอน และอิเล็กตรอนในนิวเคลียสของอะตอม
10. ธาตุคลอรีน (CI) มีเลขอะตอม 17 จะอยู่ในคาบและหมู่ละที่เท่าไรของตารางธาตุ
ก. คาบ 3 หมู่ 7
ข. คาบ 7 หมู่ 3
ค. คาบ 2 หมู่ 7
ง. คาบ 3 หมู่ 8
#เฉลยข้อสอบ
1. ข
2. ค
3. ง
4. ข
5. ข
6. ก
7. ข
8. ข
9. ค
10.ก
วันพุธที่ 21 ตุลาคม พ.ศ. 2563
บทที่ 3 พันธะเคมี
สารในชีวิตประจำวันเช่นแก๊สออกซิเจนและแก๊สคาร์บอนไดออกไซด์ที่เกี่ยวข้องกับกระบวนการหายใจของสิ่งมีชีวิตน้ำเป็นของเหลวที่ใช้ในการอุปโภคและบริโภคเกลือแกงเป็นของแข็งที่ใช้ในการประกอบอาหารสารเหล่านี้ส่วนใหญ่ไม่อยู่ในรูปอะตอมเดี่ยวแต่ประกอบด้วยหลายอะตอมซึ่งอาจเป็นอะตอมชนิดเดียวกันหรือต่างชนิดกันการยึดเหนี่ยวกันของอะตอมหรือไอออนในสารเรียกว่าพันธะเคมี
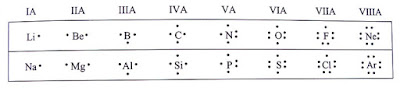
3.1 ลักษณะแบบจุดของลิวอิสและกฎออกเตต
จากการศึกษาเรื่องอะตอมและสมบัติของธาตุทำให้ทราบว่าเวเลนซ์อิเล็กตรอนเป็นอิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมธาตุคาร์บอนมีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อยเป็น 1s^2 2s^2 2p^2 ดังนั้น คาร์บอนมีเวเลนซ์อิเล็กตรอนเท่ากับ 4 ทั้งนี้การเกิดพันธะเคมีเกี่ยวข้องกับเวเลนซ์อิเล็กตรอนของอะตอมที่ร่วมสร้างพันธะกัน
เวเลนซ์อิเล็กตรอนของธาตุอาจแสดงด้วยจุดสัญลักษณ์ที่แสดงธาตุและเวเลนซ์อิเล็กตรอนของธาตุเรียกว่า สัญลักษณ์แบบจุดของลิวอิสซึ่งเสนอโดย กิลเบิร์ต นิวตัน ลิวอิส สัญลักษณ์แบบจุดของลิวอิสใช้จุดแสดงจำนวนเวเลนซ์อิเล็กตรอนรอบสัญลักษณ์ของธาตุดังรูป
จากการศึกษาเรื่องอะตอมและสมบัติของธาตุทำให้ทราบว่าเวเลนซ์อิเล็กตรอนเป็นอิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมธาตุคาร์บอนมีการจัดเรียงอิเล็กตรอนในระดับพลังงานย่อยเป็น 1s^2 2s^2 2p^2 ดังนั้น คาร์บอนมีเวเลนซ์อิเล็กตรอนเท่ากับ 4 ทั้งนี้การเกิดพันธะเคมีเกี่ยวข้องกับเวเลนซ์อิเล็กตรอนของอะตอมที่ร่วมสร้างพันธะกัน
เวเลนซ์อิเล็กตรอนของธาตุอาจแสดงด้วยจุดสัญลักษณ์ที่แสดงธาตุและเวเลนซ์อิเล็กตรอนของธาตุเรียกว่า สัญลักษณ์แบบจุดของลิวอิสซึ่งเสนอโดย กิลเบิร์ต นิวตัน ลิวอิส สัญลักษณ์แบบจุดของลิวอิสใช้จุดแสดงจำนวนเวเลนซ์อิเล็กตรอนรอบสัญลักษณ์ของธาตุดังรูป
3.2 พันธะไอออนิก
สารที่เกิดจากธาตุโลหะกับธาตุอโลหะ มีสมบัติบางประการทางการและสารเหล่านี้มีการยึดเหนี่ยวระหว่างอนุภาคที่เหมือนกัน
3.2.1 การเกิดพันธะไอออนิก
ธาตุโลหะมีพลังงานไอออไนเซชันต่ำจึงเสียอิเล็กตรอนเกิดเป็นไอออนบวกได้ง่ายส่วนธาตุอโลหะมีค่าสัมพรรคภาพอิเล็กตรอนสูง จึงรับอิเล็กตรอนเกิดเป็นไอออนลบ ไอออนบวกและไอออนลบมีประจุไฟฟ้าต่างกันจึงยึดเหนี่ยวกันด้วยแรงดึงดูดระหว่างประจุไฟฟ้าเรียกการยึดเหนี่ยวนี้ว่าพันธะไอออนิกและสารที่เกิดขึ้นจากพันธะไอออนิกว่าสารประกอบไอออนิกชื่อสารประกอบไอออนิกที่เกิดขึ้นส่วนใหญ่เป็นไปตามกฎออกเตตดังตัวอย่าง
สารประกอบไอออนิกในสถานะของแข็งอยู่ในรูปของผลึกที่มีไอออนบวกและไอออนลบยึดเหนี่ยวกันด้วยพันธะไอออนิกอย่างต่อเนื่องกันไปทั้ง 3 มิติเป็นโครงผลึก และไม่อยู่ในรูปโมเลกุล
3.2.2 สูตรเคมีและชื่อของสารประกอบไอออนิก สารประกอบไอออนิกประกอบด้วยไอออนบวกและไอออนลบที่มีประจุต่างกัน ซึ่งมีผลต่ออัตราส่วนการรวมของไอออนและสูตรของสารประกอบไอออนิกด้วยประจุของไอออน 5 มูลหลักเป็นบวกตามจำนวนและการที่ให้หรือเป็นโรคตามจำนวนอิเล็กตรอนที่รับเพื่อทำให้มีการจัดเรียงอิเล็กตรอนของไอออนเป็นไปตามกฎออกเตต
จากตาราง 3.1 ถ้าโซเดียมซึ่งเป็นธาตุหมู่ IA เมื่อเกิดเป็นไอออนบวกจะมีประจุเป็นบวก 1 5 แคลเซียมซึ่งเป็นธาตุหมู่ IIIA เมื่อเกิดเป็นไอออนบวกจะมีประจุเป็นบวก 2 และธาตุอะลูมิเนียมซึ่งเป็นธาตุหมู่ IIIA เมื่อเกิดเป็นไอออนบวกจะมีประจุเป็นบวก 3 ดังนั้นธาตุหมู่ IA IA และ IIA เมื่อเป็นไอออนจะเป็นไอออนที่มีประจุตามเลขหมู่ 5 กรณีซึ่งเป็นธาตุหมู่ VIIA เมื่อเกิดเป็นไอออนลบจะมีประจุเป็น -1 ให้ออกซิเจนซึ่งเป็นธาตุหมู่ VIIA เมื่อเกิดเป็นไอออนลบจะมีประจุเป็น -2 และธาตุไนโตรเจนซึ่งเป็นธาตุหมู่ VA เมื่อเกิดเป็นไอออนลบจะมีประจุเป็น -3 ดังนั้นธาตุหมู่ VA VIA และ VIIA เมื่อเป็นไอออน จะเป็นไอออนลบที่มีประจุ X-8 เมื่อ X คือเลขหมู่ของธาตุอโลหะ
การที่โครงสร้างของสารประกอบไอออนิกที่มีไอออนบวกและไอออนลบยึดเหนี่ยวกันอย่างต่อเนื่องกันไปทั้ง 3 มิติเป็นโครงผลึกไม่สามารถแยกเป็นโมเลกุลได้ดังนั้นจึงใช้สูตรเอมพิริคัล แสดงอัตราส่วนอย่างต่ำของจำนวนไอออนที่เป็นองค์ประกอบซึ่งทำให้ได้ผลรวมประจุเป็นศูนย์
การเขียนสูตรสารประกอบไอออนิกจะเขียนสัญลักษณ์ของธาตุที่เป็นไอออนบวกไว้ข้างหน้าตามด้วยไอออนลบและแสดงอัตราส่วนอย่างต่ำของไอออนที่เป็นองค์ประกอบโดยเขียนตัวเลขอารบิกให้ทายไอออนทั้งนี้กรณีที่จำนวนไอออนเป็นหนึ่งไม่ต้องเขียนเช่นสารประกอบไอออนิกที่เกิดจากแคลเซียมไอออนกับฟลูออไรด์ไอออนมีอัตราส่วนประจุของ Ca^2+ ต่อ F^- เป็น 2 ต่อ 1 ซึ่งเมื่อทำให้ผลรวมของประจุเป็นศูนย์จะได้อัตราส่วนอย่างต่ำของจำนวน Ca^2+ ต่อ F^- เป็น 1:2 ดังนั้นสูตรสารประกอบเป็น CaF^2
ไอออนบางชนิดเกิดจากกลุ่มอะตอมการเขียนสูตรสารประกอบจะใช้หลักการเดียวกับไอออนบวกและไอออนลบที่เกิดจากธาตุ เช่นสูตรสารประกอบไอออนิกที่เกิดจากมีไอออนกับซัลเฟตไอออนมีอัตราส่วนประจุของ NH^4+ ต่อ SO4^2- เป็น 1 ต่อ 2 ซึ่งเมื่อทำให้ผลรวมของประจุเป็นศูนย์ จะได้อัตราส่วนอย่างต่ำของจำนวน NH^4+ ต่อ SO4^2- เป็น 2:1 ดังนั้นสูตรสารประกอบเป็น (NH4)2SO4
สารประกอบไอออนิกเกิดจากไอออนบวกและไอออนลบดังนั้นการเรียกชื่อสารประกอบไอออนิกจึงจำเป็นต้องสร้างชื่อของไอออนบวกและไอออนลบโดยชื่อของไอออนบวกเรียกตามชื่อถ้าเราลงท้ายด้วยคำว่าไอออนส่วนไอออนลบเรียกตามชื่อธาตุโดยเปลี่ยนท้ายเสียงเป็น i-de
จากตารางจะเห็นว่าชื่อไอออนลบของธาตุไฮโดรเจนออกซิเจนและไนโตรเจนมีการตัดคำว่าเช่นออกก่อนจะเปลี่ยนท้ายเป็นเสียง i-de ไอออนที่เป็นกลุ่มอะตอมมีชื่อเรียกเฉพาะโดยกลุ่มอะตอมที่เป็นไอออนบวกลงท้ายด้วย -ium ส่วนกลุ่มอะตอมที่เป็นไอออนลบอาจจะลงท้ายด้วยเสียง -ide -ite -ate
ชื่อสารประกอบไอออนิกได้จากการเรียกชื่อไอออนบวกแล้วตามด้วยชื่อไอออนลบโดยตัดคำว่าไอออนออก ดังตาราง
ชื่อสารประกอบที่เกิดจากโลหะที่มีเลขออกซิเดชันมากกว่า 1 ค่า ต้องระบุตัวเลขประจุหรือเลข ออกซิเดชันของไอออนนั้นเป็นเลขโรมันในวงเล็บดังตาราง
3.2.3 พลังงานกับการเกิดสารประกอบไอออนิก
ปฏิกิริยาเคมีนอกจากจะเกี่ยวข้องกับการเปลี่ยนแปลงของสารเคมีแล้วส่วนใหญ่ยังเกี่ยวข้องกับการเปลี่ยนแปลงพลังงานอีกด้วยซึ่ง พลังงานการเกิดของสารประกอบ สามารถหาได้จากการทดลองในการทำปฏิกิริยาระหว่างธาตุ เช่นการเกิดสารประกอบโซเดียมคลอไรด์จากโลหะโซเดียมทำปฏิกิริยากับแก๊สคลอรีนเกิดเป็นโซเดียมคลอไรด์มีการคายพลังงาน 412 กิโลจูลต่อโมล
Na(s) + 1/2Cl2(g) ---> NaCl(s) -412kJ/mol
ปฏิกิริยาเคมีเกี่ยวข้องกับการสลายพันธะและการสร้างพันธะ ซึ่งการสลายพันธะ เป็นกระบวนการดูดพลังงาน ในขณะที่การสร้างพันธะเป็นกระบวนการคายพลังงานดังนั้นปฏิกิริยาที่เกิดขึ้นจากการรวมตัวกันของไอออนบวกและไอออนลบเกิดเป็นสารประกอบไอออนิกเป็นปฏิกิริยาคายพลังงานเนื่องจากมีการสร้างพันธะไอออนิก
พลังงานที่เกี่ยวข้องกับการรวมตัวกันของไอออนบวกและไอออนลบในสารประกอบไอออนิกเรียกว่าพลังงานโครงผลึกซึ่งในทางปฏิบัติไม่สามารถทำการทดลองได้โดยนำไอออนบวกและไอออนลบที่บริสุทธิ์มาทำปฏิกิริยากันได้ค่าพลังงานดังกล่าวจึงได้จากการคำนวณโดยอาศัยขั้นตอนการเกิดปฏิกิริยาย่อยๆหลายขั้นตอนตามวัฏจักรบอร์น-ฮาเบอร์ โดยมีสมมติฐานว่าพลังงานรวมในแต่ละขั้นตอนจะเท่ากับพลังงานในการเกิดสารประกอบไอออนิกเช่นการเกิดสารประกอบโซเดียมคลอไรด์ 1 โมล ประกอบด้วยขั้นตอนต่างๆดังนี้
1.โลหะโซเดียมสถานะของแข็งระเหิดกลายเป็นแก๊ส ดูดพลังงาน 107 กิโลจูลต่อโมล เรียกพลังงานที่ใช้ในขั้นนี้ว่าพลังงานการระเหิด
Na(s) ---> Na(g) 107kJ/mol
Na(g) ---> Na^+(g) + e^- 496kJ/mol
3.โมเลกุลแก๊สคลอรีนสลายพันธะ Cl-Cl ได้อะตอมคลอรีน 2 อะตอมในสถานะแก๊ส ดูดพลังงานเท่ากับ 242 กิโลจูลต่อโมล เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานพันธะ
Cl2(g) ---> 2Cl(g) 242kJ/mol
แต่เนื่องจาก NaCl 1 โมลประกอบด้วย Cl^- 1โมลไอออน ดังนั้นพลังงานที่ใช้ในขั้นนี้จะเป็นครึ่งหนึ่งของพลังงานการสลายพันธะต่อโมลของ Cl2 นั่นคือจะใช้พลังงานเพียง 121 กิลโลจูล
Na^+ + Cl^- (g) ---> NaCl(s)
1/2Cl2(g) ---> Cl(g) 121kJ
4.อะตอมคลอรีนในสถานะแก๊สเมื่อรับอิเล็กตรอนที่หลุดออกจากอะตอมโซเดียมแล้วกลายเป็น Cl^- จะคายพลังงาน 349 กิโลจูลต่อโมล พลังงานที่ได้ในขั้นนี้เรียกว่า สัมพรรคภาพอิเล็กตรอน
Cl(g) + e^- ---> Cl^-(g) -349kJ/mol
5.เมื่อโซเดียมไอออนกับคลอไรด์ไอออนในสถานะแก๊สกันเป็นผลึกโซเดียมคลอไรด์จะคายพลังงานออกมาพลังงานที่ได้ในครั้งนี้เรียกว่า พลังงานของผลึก หรือ พลังงานแลตทิซ
Na^+ + Cl^- (g) ---> NaCl(s)
พลังงานโครงผลึก เมื่อรวมสมการของปฏิกิริยาย่อยทั้ง 5 ขั้นจะเหลือ Na และ Cl2 เป็นสารตั้งต้น และเหลือ NaCl เป็นผลิตภัณฑ์โดยสารอื่นๆและอิเล็กตรอนจะหักล้างกันหมดดังนี้
ซึ่งปฏิกิริยารวมที่ได้เหมือนกับปฏิกิริยาการเกิดสารประกอบโซเดียมคลอไรด์ดังสมการ
Na(s) +1/2Cl2(g) ---> NaCl(s)
และมีค่าพลังงานรวม = 107 + 496 + 121 + (-349) + พลังงานแลตทิซ
เนื่องจากพลังงานการเกิดสารประกอบโซเดียมคลอไรด์ซึ่งสามารถหาได้จากการทดลองมีค่าเป็น -412 kJ/mol ดังนั้นสามารถคำนวณหาค่าพลังงานแลตทิซดังนี้
-412 = 107 + 496 + 121 + (-349) + พลังงานแลตทิซ
พลังงานแลตทิซ = -787kJ/mol
ค่าพลังงานแลตทิซที่คำนวณได้มีค่าเป็นลบแสดงว่าการรวมตัวกันของโซเดียมไอออนและคลอไรด์ไอออนทำให้เกิดการคายพลังงานในทางตรงกันข้ามการสลายพันธะระหว่างโซเดียมไอออนและคลอไรด์ไอออนในโครงผลึกของโซเดียมคลอไรด์จะเป็นกระบวนการดูดพลังงานซึ่งจะมีเครื่องหมายและค่าพลังงานเป็นบวก
วัฏจักรบอร์นฮาเบอร์ ของการเกิดสารประกอบโซเดียมคลอไรด์แอนด์เขียนเป็นแผนภาพเพื่อแสดงการเปลี่ยนแปลงพลังงานได้ดังรูป
จากรูปจะสังเกตเห็นได้ว่าพลังงานที่ได้จากขั้นตอนการพลังงานมีค่ามากกว่าพลังงานที่ได้จากขั้นตอนดูดพลังงานจึงทำให้เกิดสารประกอบโซเดียมคลอไรด์เป็นปฏิกิริยาคายพลังงาน
3.2.4 สมบัติของสารประกอบไอออนิก
สารประกอบไอออนิกส่วนใหญ่เป็นผลึกที่แข็งเนื่องจากการยึดเหนี่ยวที่แข็งแรงระหว่างไอออนบวกและไอออนลบและผลึกของสารประกอบไอออนิกมีความเปราะ แตกหักได้ง่ายเนื่องจากการเลื่อนตำแหน่งเพียงเล็กน้อยของไอออนเมื่อมีแรงกระทำอาจทำให้ไอออนชนิดเดียวกันลื่นไถลไปอยู่ตำแหน่งตรงกลางจึงเกิดแรงผลักระหว่างกันดังรูป
จากรูปจะสังเกตเห็นได้ว่าพลังงานที่ได้จากขั้นตอนการพลังงานมีค่ามากกว่าพลังงานที่ได้จากขั้นตอนดูดพลังงานจึงทำให้เกิดสารประกอบโซเดียมคลอไรด์เป็นปฏิกิริยาคายพลังงาน
สารประกอบไอออนิกสถานะของแข็งไม่นำไฟฟ้าเนื่องจาก ไอออนที่เป็นองค์ประกอบยึดเหนี่ยวกันอย่างแข็งแรงไม่สามารถเคลื่อนที่ได้แต่เมื่อหลอมเหลวหรือละลายน้ำจะนำไฟฟ้าได้ดีเนื่องจากไอออนที่เป็นองค์ประกอบยึดเหนี่ยวกันอย่างแข็งแรงไม่สามารถเคลื่อนที่ได้ แต่เมื่อหลอมเหลวหรือละลายน้ำจะนำไฟฟ้าได้เนื่องจากไอออนสามารถเคลื่อนที่ได้ สารประกอบไอออนิกมีจุดหลอมเหลวและจุดเดือดสูงส่วนใหญ่ละลายน้ำได้และสารละลายของสารประกอบไอออนิกในน้ำส่วนใหญ่มีสมบัติเป็นเบสหรือกลางโดยสารละลายของสารประกอบออกไซด์มีสมบัติเป็นเบสและสารละลายของสารประกอบคลอไรด์มีสมบัติเป็นกลาง ดังตาราง
การละลายน้ำของสารประกอบไอออนิกเกี่ยวข้องกับกระบวนการที่ไอออนบวกและไอออนลบแยกออกจากโครงผลึกและเป็นกระบวนการที่โมเลกุลของน้ำล้อมรอบไอออนแต่ละชนิดโดยสารที่เมื่อละลายน้ำแล้วแตกตัวเป็นไอออนเรียกสามีว่าสารละลายอิเล็กโทรไลต์
กระบวนการที่ไอออนบวกและไอออนลบแยกออกจากโครงผลึกเป็นกระบวนการดูดพลังงานที่มีค่าเท่ากับพลังงานและแลตทิซ ดังที่ได้กล่าวมาแล้ว ส่วนกระบวนการที่โมเลกุลของน้ำล้อมรอบไอออนแต่ละชนิดเป็นกระบวนการคายพลังงานที่เรียกว่า พลังงานไฮเดรชัน
ถ้าค่าพลังงานแลตทิซ น้อยกว่าค่าพลังงานไฮเดรชันการละลายจะเป็นกระบวนการคายพลังงานซึ่งจะทำให้อุณหภูมิของสารละลายสูงขึ้นและสารละลายจะละลายได้ดีที่อุณหภูมิต่ำในทางกลับกันถ้าค่าพลังงานแลตทิซมากกว่าค่าพลังงานไฮเดรชันการละลายจะเป็นกระบวนการดูดพลังงานซึ่งจะทำให้อุณหภูมิของสารละลายลดลงและสารจะละลายได้ดีที่อุณหภูมิสูงในกรณีที่มีค่าพลังงานแลตทิซมากกว่าพลังงานไฮเดรชันมากๆ สารอาจจะละลายได้น้อยมากหรือไม่ละลาย
จากที่ทราบแล้วว่าสารประกอบไอออนิกเมื่อละลายน้ำไอออนบวกและไอออนลบจะแยกออกจากกันถ้าการผสมสารละลายของสารประกอบไอออนิกทำให้เกิดตะกอนแสดงว่าไอออนในสารละลายผสมทำปฏิกิริยากันเกิดเป็นสารใหม่ที่ไม่ละลายน้ำ ดังรูป
ปฏิกิริยาการเกิดตะกอนของสารประกอบไอออนิกในน้ำอาจเขียนแทนด้วยสมการไอออนิก ที่แสดงไอออนในสารละลายครบทุกชนิดเช่นปฏิกิริยาระหว่างสารละลายซิลเวอร์ไนเตรตกับสารละลายโซเดียมคลอไรด์เขียนสมการไอออนิกได้ดังนี้
Ag^+(aq) + NO3^-(aq) + Na^+(aq) + Cl^-(aq) ---> AgCl(s) + NO3^-(aq) + Na^+(aq)
ไอออนในสมการของปฏิกิริยาที่มีน้ำเป็นตัวทำละลายแสดงสถานะไอออนเป็น aq ซึ่งมาจากคำว่า a queous solution เนื่องจากในสมการไอออนิกมีไอออนที่ไม่ทำปฏิกิริยาการปรากฏอยู่ทางด้านซ้ายและด้านขวาของสมการที่สามารถตัดออกจากสมการให้เหลือเฉพาะไอออนที่ทำปฏิกิริยากันได้เป็นผลิตภัณฑ์เรียกว่า สมการไอออนสุทธิ
Ag^+(aq) + Cl^-(aq) ---> AgCl(s)
การอธิบายหรือการทำนายปฏิกิริยาการเกิดตะกอนของสารละลายของสารประกอบไอออนิก สามารถพิจารณาได้จากสมบัติการละลายน้ำตามหลักการเบื้องต้นดังนี้
สารประกอบที่ละลายน้ำ
-สารประกอบของโลหะแอลคาไลและแอมโมเนียทุกชนิด
-สารประกอบไนเทรต คลอเรต เปอร์คลอเรต แอซีเตต
-สารประกอบคลอไรด์ โบรไมด์ ไอโอไดด์
-สารประกอบคอร์บอเนต ฟอสเฟต ซัลไฟด์ และซัลไฟต์
-สารประกอบซัลเฟต
สารประกอบที่ไม่ละลายน้ำ
-สารประกอบออกไซด์ของโลหะ
-สารประกอบไฮดรอกไซด์
3.3 พันธะโคเวเลนต์
สารที่เกิดจากธาตุอโลหะรวมตัวกันเช่นแก๊สออกซิเจนแก๊สไนโตรเจนและแก๊สคาร์บอนไดออกไซด์ การยึดเหนี่ยวระหว่างอะตอมของธาตุในสารเหล่านี้เป็นพันธะไอออนิกหรือไม่เพราะเหตุใด
3.3.1 การเกิดพันธะโคเวเลนต์
ธาตุอโลหะมีค่าอิเล็กโทรเนกาติวิตีสูงดังนั้นเมื่อรวมตัวกันจะไม่มีอะตอมใดยอมเสียอิเล็กตรอน อะตอมจึงยึดเหนี่ยวกันโดยใช้เวเลนซ์เล็กตรอนร่วมกันเรียกการยึดเหนี่ยวในว่าพันธะโคเวเลนต์แล้วนะสารที่อะตอมยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ว่าสารโคเวเลนต์ซึ่งส่วนใหญ่อยู่ในรูปโมเลกุลโดยการเกิดพันธะในโมเลกุลโคเวเลนต์ส่วนใหญ่เป็นไปตามกฎออกเตตดังตัวอย่าง
คลอรีนมีเวเลนซ์อิเล็กตรอนเท่ากับ 7 ดังนั้นข้อดีทั้ง 2 อะตอมจะใช้เวลาดิจิตอลร่วมกัน 1 คู่เพื่อให้มีเวเลนซ์อิเล็กตรอนครบ 8 ตามกฎออกเตต เขียนแผนภาพและสัญลักษณ์แบบจุดของลิวอิสแสดงการเกิดพันธะได้ดังนี้
พันธะโคเวเลนต์ในโมเลกุลแก๊สคลอรีนเกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน 1 คู่พันธะนี้เรียกว่าพันธะเดี่ยว ด้วยอิเล็กตรอนคู่ที่ใช้ร่วมกันในการเกิดพันธะเรียกว่าอิเล็กตรอนคู่ร่วมพันธะส่วนอิเล็กตรอนคู่ที่ไม่ได้เกิดพันธะเรียกว่าอิเล็กตรอนคู่โดดเดี่ยวซึ่งในโมเลกุลแก๊สคลอรีนมีอิเล็กตรอนคู่ร่วมพันธะ 1 คู่และมีอิเล็กตรอนคู่โดดเดี่ยว 6 คู่
อีกทั้งยังมีการเกิดพันธะในโมเลกุล ออกซิเจนแต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 6 ดังนั้นออกซิเจนทั้ง 2 อะตอมจะใช้เวทีเล็กตอนร่วมกัน 2 คู่เพื่อให้เป็นไปตามกฎออกเตต เกิดพันธะโคเวเลนต์แบบพันธะคู่ นอกจากนี้พันธะโคเวเลนต์ยังอาจเป็นพันธะสาม เช่นในโมเลกุลแก๊สไนโตรเจนไนโตรเจนแต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 5 ดังนั้นไนโตรเจนทั้ง 2 อะตอมจะใช้เวลาที่เล็กตอนร่วมกัน 3 คู่เพื่อให้เป็นไปตามกฎออกเตต
ในโครงสร้างลิวอิส อิเล็กตรอนคู่ร่วมพันธะสามารถแสดงได้ด้วยเส้นพันธะในขณะที่อิเล็กตรอนคู่โดดเดี่ยวแสดงด้วยจุดคู่เสมอเช่นโมเลกุลแอมโมเนียมีเส้นพันธะ N-H 3 พันธะ แทนอิเล็กตรอนคู่ร่วมพันธะ 3 คู่ ในขณะที่อีเล็คตรอนคู่โดดเดี่ยว 1 คู่แสดงด้วยจุดคู่บนอะตอมไนโตรเจนอิเล็กตรอนคู่โดดเดี่ยวนี้สามารถสร้างพันธะกับ H^+ เกิดเป็นแอมโมเนียมไอออน จำนวนอิเล็กตรอนรอบอะตอมกลางยังคงเป็นไปตามกฎออกเตต ในกรณีที่พันธะโคเวเลนต์ที่เกิดขึ้นมาจากอะตอมไนโตรเจนเท่ากัน แสดงดังนี้
สารโคเวเลนต์บางชนิดอาจมีอะตอมกลางที่มีจำนวนอิเล็กตรอนล้อมรอบไม่เป็นไปตามกฎออกเตต
3.3.2 สูตรโมเลกุลและชื่อของสารโคเวเลนต์
สูตรโมเลกุลของสารโคเวเลนต์โดยทั่วไปเขียนสัญลักษณ์ของธาตุองค์ประกอบโดยเรียงลำดับจากค่าอิเล็กโทรเนกาติวิตีน้อยไปมากพร้อมทั้งระบุจำนวนอะตอมของธาตุที่มีจำนวนอะตอมมากกว่า 1 อะตอมยกเว้นสามารถชนิดเช่น NH3 และ CH4 ทั้งที่ถ้าไนโตรเจนและธาตุคาร์บอนมีอิเล็กโทรเนกาติวิตีสูงกว่าธาตุไฮโดรเจน
การเรียกชื่อสารโคเวเลนต์มีหลักการดังนี้
1.สารโคเวเลนต์ที่ประกอบด้วยธาตุชนิดเดียวกันเรียกตามชื่อท่านนั้นซึ่งท่านเหล่านี้ส่วนใหญ่มีสถานะเป็นแก๊สที่อุณหภูมิห้องจึงนิยมเรียกชื่อโดยระบุสถานะด้วยเพื่อให้ทราบว่าเป็นการกล่าวถึงโมเลกุลที่ไม่ใช่อะตอมของธาตุเช่นแก๊สออกซิเจน
2.สารโคเวเลนต์ที่ประกอบด้วยธาตุ 2 ชนิดให้เรียกชื่อธาตุตามลำดับที่ปรากฏในสูตรโมเลกุลโดยเปลี่ยนพยางค์ท้ายเป็น -ide และระบุจำนวนอะตอมองค์ประกอบ ในโมเลกุลด้วยคำภาษากรีก ดังตาราง
ยกเว้นกรณีที่ธาตุและมีเพียงอะตอมเดียวไม่ต้องระบุจำนวนอะตอมของธาตุนั้น
การเรียกชื่อสารโคเวเลนต์ที่เป็นสารประกอบออกไซด์นอกจากเรียกชื่อสารตามหลักการข้างต้นแล้วยังนิยมเรียกชื่อสารโดยแต่ละตัวสุดท้ายของคำที่ระบุจำนวนอะตอมออก เช่น CO นิยมเรียกว่าคาร์บอนมอนอกไซด์ นอกจากนี้สารบางชนิดยังมีเพียงชื่อเล่นโดยไม่เป็นไปตามหลักการข้างต้นครบทุกประการเช่น HCl นิยมเรียกว่าไฮโดรเจนคลอไรด์ แทนที่จะเรียกว่าไฮโดรเจนมอนอคลอไรด์
3.3.3 ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
อะตอมไฮโดรเจน 2 อะตอมเคลื่อนที่เข้ากันจะเกิดแรงดึงดูดระหว่างอิเล็กตรอนของอะตอมหนึ่งกับโปรตอนในนิวเคลียสของอะตอมหนึ่งขณะเดียวกันก็มีแรงผลักระหว่างโปรตอนกับโปรตอนและอิเล็กตรอนกับอิเล็กตรอนของอะตอมทั้งสองด้วย แรงดึงดูดทำให้พลังงานศักย์ลดลงแต่แรงผลักทำให้พลังงานศักย์เพิ่มขึ้น ทำให้พลังงานศักย์รวมลดลงแล้วเพิ่มขึ้นตามระยะห่างระหว่างนิวเคลียสโดยมีผลรวมพลังงานศักย์ต่ำที่สุดเมื่อระยะทางระหว่างนิวเคลียสทั้งสองเท่ากับ 74 พิโกเมตร ถ้าอะตอมเคลื่อนที่เข้าใกล้กันมากกว่านี้และหากจะมีมากกว่าแรงดึงดูดซึ่งทำให้พลังงานศักย์รวมเพิ่มขึ้น
จากรูประยะห่างระหว่างนิวเคลียสที่ทำให้พลังงานศักย์รวมต่ำที่สุดเรียกว่าความยาวพันธะ ในทางปฏิบัติความยาวพันธะได้จากการศึกษาการเลี้ยวเบนของรังสีเอกซ์ เมื่อผ่านโครงผลึกของสารหรือจากการวิเคราะห์สเปกตรัมของโมเลกุลสาร ซึ่งพบว่าความยาวพันธะมีแนวโน้มเพิ่มขึ้นตามขนาดอะตอมคู่ร่วมพันธะและการใช้อิเล็กตรอนร่วมกันทำให้ความยาวพันธะโคเวเลนต์สั้นกว่าผลรวมของรัศมีอะตอมอิสระที่มาสร้างพันธะกันสำหรับอะตอมคู่ร่วมพันธะเดียวกันความยาวพันธะจะลดลงจากพันธะเดี่ยวพันธะคู่และพันธะสามตามลำดับอย่างไรก็ตามความยาวพันธะชนิดเดียวกันระหว่างอะตอมคู่เดียวกันอาจจะไม่เท่ากันในสารต่างชนิดกัน
ในการประมาณความยาวพันธะระหว่างอะตอมคู่หนึ่ง โดยทั่วไปนิยมใช้ความยาวพันธะเฉลี่ย การศึกษาความยาวพันธะของโมเลกุลโคเวเลนต์นำไปสู่การอธิบายการเกิดพันธะในโมเลกุลของสารโคเวเลนต์บางชนิดที่สามารถเขียนโครงสร้างลิวอิสตามกฎออกเตตได้มากกว่า 1 โครงสร้างเช่นโมเลกุลโอโซนมีโครงสร้างลิวอิส 2 โครงสร้างซึ่งประกอบด้วยพันธะเดี่ยวและพันธะคู่ระหว่างออกซิเจนที่ควรมีค่าความยาวพันธะไม่เท่ากัน แต่จากการศึกษาพบว่าความยาวพันธะระหว่างออกซิเจนมีค่าเท่ากับ 128 พิโกเมตรเพียงค่าเดียว ซึ่งเป็นค่าที่อยู่ระหว่างความยาวพันธะ O-O (148 พิโกเมตร) และพันธะ O=O (121 พิโกเมตร) แสดงว่าพันธะทั้งสองในโมเลกุลโอโซนเป็นพันธะชนิดเดียวกันที่อาจอธิบายได้โดยทฤษฎี เรโซแนนซ์ ว่าอิเล็กตรอนคู่ร่วมพันธะ 1 คู่เคลื่อนย้ายไปมาระหว่างอะตอมทั้ง 3 ทำให้เกิดโครงสร้างผสมระหว่าง 2 โครงสร้างการเคลื่อนย้ายตำแหน่งของอิเล็กตรอนคู่ร่วมพันธะในโมเลกุลที่เขียนโครงสร้างลิวอิสได้มากกว่าหนึ่งแบบเรียกว่า เรโซแนนซ์ และเรียกโครงสร้างลิวอิสแต่ละแบบว่า โครงสร้างเรโซแนนซ์ โดยแสดงการเกิดเรโซแนนซ์ระหว่างโครงสร้างด้วยลูกศร 2 หัวและเรียกโครงสร้างผสมของโครงสร้างเรโซแนนซ์ทุกโครงสร้างว่าโครงสร้างเรโซแนนซ์ผสม ดังรูป
นอกจากความยาวพันธะแล้ว กราฟที่แสดงการเปลี่ยนแปลงพลังงานในการเกิดโมเลกุลแก๊สไฮโดรเจนและแสดงให้เห็นว่าโมเลกุลแก๊สไฮโดรเจนมีพลังงานต่ำกว่าอะตอมไฮโดรเจน 436 กิโลจูลต่อโมล หมายความว่าการทำให้โมเลกุลแก๊สไฮโดรเจน 1 โมเลกุลแยกออกเป็นอะตอมไฮโดรเจน 2 อะตอมต้องใช้พลังงานอย่างน้อย 436 กิโลจูลต่อโมลในการสลายพันธะ ระหว่างอะตอมไฮโดรเจนดังสมการ
H2(g) + 436 kJ/mol ---> 2H(g)
ในทางกลับกัน อะตอมไฮโดรเจน 2 อะตอมสร้างพันธะระหว่างกันเกิดเป็นโมเลกุลแก๊สไฮโดรเจน 1 โมเลกุลจะคายพลังงาน 436 กิโลจูลต่อโมล ดังนี้
2H(g) ---> H2(g) + 436 kJ/mol
พลังงานปริมาณน้อยที่สุดที่ใช้ในการสลายพันธะระหว่างอะตอมคู่ร่วมพันธะในโมเลกุลในสถานะแก๊สให้เป็นอะตอมเดี่ยวในสถานะแก๊สเรียกว่าพลังงานพันธะซึ่งส่วนใหญ่ใช้หน่วยเป็นกิโลจูลต่อโมล
การประมาณพลังงานพันธะระหว่างอะตอมคู่หนึ่งโดยทั่วไปนิยมใช้พลังงานพันธะเฉลี่ยดังตาราง
จากตาราง จะเห็นว่าพันธะระหว่างคาร์บอนมีทั้งพันธะเดี่ยวพันธะคู่และพันธะสามซึ่งมีค่าพลังงานพันธะเป็น 346 614 และ 839 กิโลจูลต่อโมลตามลำดับ แสดงว่าพันธะสามแข็งแรงกว่าพันธะคู่และพันธะคู่แข็งแรงกว่าพันๆเดี่ยวและถ้าพิจารณาอะตอมคู่ร่วมพันธะๆเดียวกันของแท้ที่มีค่าพลังงานน้อยจะมีความยาวพันธะมาก นอกจากอะตอมคู่ร่วมพันธะเดียวกันแล้วความสัมพันธ์นี้ยังสามารถใช้เปรียบเทียบพันธะของธาตุในหมู่เดียวกันได้อีกด้วย
ปฏิกิริยาเคมีที่เกี่ยวข้องกับกระบวนการสลายพันธะในสารตั้งต้นและการสร้างพันธะเกิดเป็นผลิตภัณฑ์โดยการสลายพันธะเป็นกระบวนการดูด (E1) พลังงานซึ่งมีค่าเป็นบวกและการสร้างพันธะจะมีค่าเป็นลบเป็นกระบวนการคายพลังงาน (E2) และพลังงานของปฏิกิริยา (เดลต้า H) คำนวณได้จากผลรวมของ
E1 และ E2 เดลต้า H = E1 + E2
ถ้าพลังงานที่ใช้สลายพันธะมีค่ามากกว่าพลังงานที่ใช้สร้างพันธะจะได้ เดลต้า H มีเครื่องหมายเป็นบวก แสดงว่าปฏิกิริยานั้นเป็นปฏิกิริยาดูดพลังงานในทางกลับกันถ้าพลังงานที่คายออกมาจากการสร้างสรรค์ๆมีค่ามากกว่าพลังงานที่ต้องใช้สลายพันธะ จะได้เดลต้า H มีเครื่องหมายเป็นลบ แสดงว่าปฏิกิริยานั้นเป็นปฏิกิริยาคายพลังงาน
3.3.4 รูปร่างโมเลกุลโคเวเลนต์
โมเลกุลโคเวเลนต์ที่ประกอบด้วยอะตอมมากกว่า 2 อะตอมนอกจากความยาวพันธะและพลังงานพันธะแล้วข้อมูลที่ใช้ในการอธิบายสมบัติของสารคือ รูปร่างโมเลกุล ในโมเลกุลของน้ำคาร์บอนไดออกไซด์แอมโมเนียและโบรอนไตรฟลูออไรด์มีรูปร่างเป็นโมเลกุลที่ต่างกันหรือไม่อย่างไรเนื่องจากโมเลกุลมีขนาดเล็กมากจึงไม่สามารถพิจารณารูปร่างโมเลกุลได้โดยตรงและสามารถศึกษาเกี่ยวกับรูปร่างโมเลกุลโดยการจำลองตำแหน่งของคู่อิเล็กตรอน ในการทดลอง ดังนี้
คลิกเพื่อเข้าดูการทดลองได้เลย : การจัดตัวของลูกโป่งกับรูปร่างโมเลกุลโคเวเลนต์
จากกิจกรรม ในตอนที่ 1 ลูกโป่งแต่ละลูกซึ่งมีปริมาตรเท่ากันเมื่อนำมาผูกข้อติดกันพบว่าลูกโป่งแต่ละรูปผัดกันเกิดการจับตัวเป็นรูปร่างต่างๆที่สมมาตรในที่มีลูกโป่งเป็นตัวแทนของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมกลางและอะตอมล้อมรอบซึ่งอิเล็กตรอนเหล่านี้จะผลักกันด้วยแรงกระทำระหว่างประจุชนิดเดียวกันทำให้ได้คิดค่าของพันธะอยู่ห่างกันมากที่สุดเกิดเป็นรูปร่างโมเลกุลในลักษณะเดียวกันกับการจัดตัวของลูกโป่ง และในกิจกรรมตอนที่ 2 ลูกโป่งต่างสีใช้แทนอิเล็กตรอนคู่ร่วมพันธะและอิเล็กตรอนคู่โดดเดี่ยวซึ่งรูปร่างโมเลกุลพิจารณาจากตำแหน่งของอะตอมทั้งหมดโดยไม่นำตำแหน่งของอิเล็กตรอนคู่โดดเดี่ยวมาพิจารณา การคาดคะเนรูปร่างโมเลกุลจากโครงสร้างลิวอิสโดยอาศัยการผลักกันของอิเล็กตรอนคู่ร่วมพันธะและอิเล็กตรอนคู่โดดเดี่ยวอาจใช้ทฤษฎีการผลักระหว่างคู่อิเล็กตรอนในวงเวเลนซ์ (VSEPR) โดยทฤษฎีนี้มีหลักการว่าอิเล็กตรอนคู่โดดเดี่ยวอยู่ใกล้นิวเคลียสมากกว่าอิเล็กตรอนคู่ร่วมพันธะดังนั้นรหัสระหว่างอิเล็กตรอนคู่โดดเดี่ยวด้วยกันจึงมีค่ามากกว่าแรงผลักระหว่างอิเล็กตรอนคู่ร่วมพันธะกับอิเล็กตรอนคู่โดดเดี่ยว และมากกว่าแรงผลักระหว่างอิเล็กตรอนคู่ร่วมพันธะด้วยกัน
จากผลการทดลองกิจกรรมการจับตัวของลูกโป่งกับรูปร่างโมเลกุลโคเวเลนต์สรุปรูปร่างโมเลกุลโคเวเลนต์ดังตาราง

3.3.5 สภาพขั้วของโมเลกุลโคเวเลนต์
สารโคเวเลนต์ที่เกิดจากอะตอมชนิดเดียวกันเช่นแก๊สไฮโดรเจนมีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมทั้งสองเท่ากันทั้งๆที่เกิดขึ้นในลักษณะเช่นนี้จะเรียกว่าพันธะโคเวเลนต์ไม่มีขั้วและสารโคเวเลนต์ที่เกิดจากอะตอมต่างชนิดกันและมีค่าอิเล็กโทรเนกาติวิตีแตกต่างกันจะมีการกระจายของกลุ่มหมอกอิเล็กตรอนคู่ร่วมพันธะระหว่างอะตอมไม่เท่ากันเช่นไฮโดรเจนคลอไรด์มีอิเล็กตรอนคู่ร่วมพันธะอยู่บริเวณอะตอมคลอรีนมากกว่าอะตอมไฮโดรเจนเพราะอะตอมคลอรีนมีค่าอิเล็กโทรเนกาติวิตีมากกว่าอะตอมไฮโดรเจนทำให้อะตอมของดีแสดงประจุไฟฟ้าค่อนข้างรถยนต์อะตอมไฮโดรเจนมีค่าอิเล็กโทรเนกาติวิตีน้อยกว่าแสดงประจุไฟฟ้าค่อนข้างบวก ที่เกิดขึ้นลักษณะนี้เรียกว่าพันธะโคเวเลนต์มีขั้ว การแสดงขั้วของพันธะอาจใช้สัญลักษณ์ เดลต้าบวก สำหรับอะตอมที่แสดงประจุไฟฟ้าค่อนข้างบวก และเดลต้าลบ สำหรับอะตอมที่แสดงประจุไฟฟ้าค่อนข้างลบหรืออาจใช้เครื่องหมายโดยให้หัวลูกศรหันชี้ไปในทิศของอะตอมที่แสดงประจุไฟฟ้าค่อนข้างลบส่วนท้ายลูกศร ที่มีลักษณะคล้ายเครื่องหมายบวกให้อยู่บริเวณอะตอมที่แสดงประจุไฟฟ้าค่อนข้างบวก
ของพันธะทำให้โมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุชนิดเดียวกันเป็นโมเลกุลไม่มีขั้วโมเลกุลอะตอมคู่ที่ประกอบด้วยธาตุต่างชนิดกันเป็นโมเลกุลมีขั้วและโมเลกุลโคเวเลนต์ที่ประกอบด้วยอะตอมมากกว่า 2 อะตอม และพันธะระหว่างครูอะตอมเป็นพันธะมีขั้วจะเป็นโมเลกุลมีขั้วหรือไม่อย่างไร สภาพขั้วของโมเลกุลที่ประกอบด้วยอะตอมมากกว่า 2 อะตอมพิจารณาจากการรวมสภาพขั้วของพันธะแบบเวกเตอร์ ซึ่งถ้าเวกเตอร์ หักหลังกันหมดจะทำให้โมเลกุลไม่มีขั้วแต่ถ้าเวกเตอร์แทนละกันไม่หมดโมเลกุลจะเป็นโมเลกุลที่มีขั้ว
โมเลกุลที่อะตอมกลางไม่มีอิเล็กตรอนคู่โดดเดี่ยว และอะตอมล้อมรอบเหมือนกันทุกอะตอมเป็นโมเลกุลไม่มีขั้วถึงแม้ว่าพันธะภายในโมเลกุลจะเป็นพันธะที่มีขั้วแต่เนื่องจากรูปร่างโมเลกุล
สำหรับโมเลกุลที่อะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวหรือมีอะตอมล้อมรอบเป็นธาตุต่างชนิดกันส่วนใหญ่เป็นโมเลกุลมีขั้วเนื่องจากเวกเตอร์สภาพขั้วของพันธะหักล้างกันไม่หมด
โมเลกุลอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวส่วนใหญ่เป็นโมเลกุลแบบมีขั้วและมีบางชนิดอาจเป็นโมเลกุลไม่มีขั้วเนื่องจากมีรูปร่างโมเลกุลแบบสี่เหลี่ยมแบนราบทำให้เวกเตอร์สภาพขั้วหักล้างกันหมดโมเลกุลอะตอมกลางมีอิเล็กตรอนคู่โดดเดี่ยวส่วนใหญ่เป็นโมเลกุลแบบมีขั้วและมีบางชนิดอาจเป็นโมเลกุลไม่มีขั้วเนื่องจากมีรูปร่างโมเลกุลแบบสี่เหลี่ยมแบนราบทำให้เวกเตอร์สภาพขั้วหักล้างกันหมด
3.3.6 แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารโคเวเลนต์
ที่อุณหภูมิห้องสารโคเวเลนต์แต่ละชนิดอันอยู่ในสถานะที่แตกต่างกันทั้งนี้ขึ้นอยู่กับแรงยึดเหนี่ยวระหว่างโมเลกุลหรือแรงแวนเดอร์วาลส์ โดยในสถานะของแข็งโมเลกุลอยู่ชิดกันจนไม่สามารถเคลื่อนที่ได้และมีแรงยึดเหนี่ยวระหว่างโมเลกุลมากในสถานะของเหลวโมเลกุลสามารถเคลื่อนที่ได้แต่ยังคงอยู่ชิดติดกันและมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยกว่าในของแข็งส่วนในสถานะแก๊สโมเลกุลอยู่ห่างกันสามารถเคลื่อนที่ได้อย่างอิสระและมีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อยมากจนถือว่าไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุลดังนั้นการเปลี่ยนแปลงสถานะของสารจากของแข็งไปเป็นของเหลว หรือของเหลวไปเป็นแก๊สซึ่งเกี่ยวข้องกับการทำลายงานยึดเหนี่ยวระหว่างโมเลกุลโดยไม่มีการทำลายพันธะโคเวเลนต์ ซึ่งแรงยึดเหนี่ยวระหว่างโมเลกุลมีค่าพลังงานน้อยกว่าพันธะโคเวเลนต์มากสามารถทำลายได้ด้วยการให้พลังงานความร้อนแก้สารจนกระทั่งโมเลกุลของสารมีพลังงานจลน์สูงพอที่จะเกิดการเปลี่ยนแปลงสถานะได้ดังนั้นสารแต่ละชนิดซึ่งมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่แตกต่างกันจะมีจุดหลอมเหลวและจุดเดือดที่ต่างกันด้วย
นอกจากจุดหลอมเหลวของสารที่จะเกี่ยวข้องกับแรงยึดเหนี่ยวระหว่างโมเลกุลแล้วยังขึ้นอยู่กับการจัดเรียงโมเลกุลในของแข็งทำให้แนวโน้มของจุดหลอมเหลวอาจไม่สอดคล้องกับแรงยึดเหนี่ยวระหว่างโมเลกุลโดยตรง
แรงยึดเหนี่ยวระหว่างโมเลกุลเกี่ยวข้องกับขนาดของโมเลกุลและสภาพขั้วของโมเลกุลซึ่งแรงยึดเหนี่ยวระหว่างโมเลกุลมีหลายชนิดและมีชื่อเรียกที่ต่างกันซึ่งในที่นี้จะกล่าวถึง 3 ชนิดที่สำคัญดังนี้
1.และแพร่กระจายลอนดอน แรงแพร่กระจายลอนดอน เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลไม่มีขั้วหรืออะตอมแก๊สมีสกุลซึ่งเป็นแรงอย่างอ่อนๆที่เกิดขึ้นจากการกระจายของอิเล็กตรอนในอะตอมขณะใดขณะหนึ่งซึ่งอาจไม่เท่ากันจึงทำให้สภาพขั้วชั่วขณะ แล้วเหนี่ยวนำให้โมเลกุลที่อยู่ติดกันเกิดขั้วตรงข้ามและมีแรงดึงดูดชั่วขณะ โดยแรงแผ่กระจายนี้เพิ่มขึ้นตามขนาดของโมเลกุลเนื่องจากโมเลกุลขนาดใหญ่สามารถเกิดสภาพขั้วชั่วขณะได้มากกว่า
2.แรงระหว่างขั้วสำหรับโมเลกุลมีขั้วนอกจากจะมีแรงแผ่กระจายลอนดอนแล้ว ยังมีแรงดึงดูดที่เกิดจากสภาพของขั้วโมเลกุลด้วยโมเลกุลที่อยู่ใกล้กันจะหันส่วนของโมเลกุลที่มีขั้วตรงข้ามกันเข้าหากันเกิดเป็นแรงดึงดูดทางไฟฟ้าจากสภาพขั้วนี้โดยทั่วไปในระหว่างขั้วเพิ่มขึ้นตามสภาพขั้วของโมเลกุลที่มีขนาดใกล้เคียงกัน
3.พันธะไฮโดรเจนเมื่อพิจารณาจุดเดือดของสารประกอบไฮโดรเจนกับธาตุหมู่ VIIA จะเห็นว่า HF มีจุดเดือดสูงกว่าสารประกอบอื่นทั้งที่มีขนาดโมเลกุลเล็กที่สุดซึ่งไม่เป็นไปตามแนวโน้มของขนาดโมเลกุลดังที่ได้กล่าวมาแล้วข้างต้นแสดงว่า HF มีแรงดึงดูดระหว่างโมเลกุลมากกว่าสารประกอบของไฮโดรเจนกับธาตุหมู่ VIIA อื่นๆ ทั้งนี้เพราะผลต่างของค่าอิเล็กโทรเนกาติวิตีระหว่างไฮโดรเจนกับฟลูออรีนมีค่ามากทำให้กลุ่มหมอกอิเล็กตรอนอยู่ทางด้านอะตอมฟลูออรีนที่มีขนาดเล็กอย่างหนาแน่นอะตอมฟลูออรีนและไฮโดรเจนมีสภาพขั้วสูงกว่าในกรณีที่ HCl HBr และ HI มาก ทำให้มีแรงดึงดูดระหว่างโมเลกุลมากด้วยแรงดึงดูดระหว่างโมเลกุลที่เกิดขึ้นจากอะตอมไฮโดรเจนของโมเลกุลหนึ่งกับอิเล็กตรอนคู่โดดเดี่ยวบนอะตอมของธาตุที่มีขนาดเล็กและมีอิเล็กโทรเนกาติวิตีสูงของอีโมเลกุลหนึ่งเรียกแรงดึงดูดนี้ว่า พันธะไฮโดรเจน
3.4 พันธะโลหะ
โลหะบางชนิดเส้นทองแดง เหล็กอะลูมิเนียมมีสมบัติบางประการคล้ายกับแสดงว่าสารเหล่านี้มีการยึดเหนี่ยวกันระหว่างอนุภาคที่เหมือนกันและอะตอมธาตุโลหะสร้างพันธะเคมีระหว่างกันอย่างไรเหมือนหรือต่างกัน จากพันธะไอออนิกและโคเวเลนต์หรือไม่
3.4.1 การเกิดพันธะโลหะ
จากที่ทราบแล้วว่าโลหะส่วนใหญ่มีสถานะเป็นของแข็งมีจุดหลอมเหลวและจุดเดือดสูงผิวมันวาวสามารถนำไฟฟ้าและความร้อนได้ดีจะสมบัติดังกล่าวจะเห็นว่าโลหะมีสมบัติบางประการของสารประกอบไอออนิกและมีสมบัติบางประการที่แตกต่างจากสารประกอบไอออนิกเช่นการนำไฟฟ้าและการนำความร้อนได้ดีในสถานะของแข็งผิวมันวาวและสมบัติส่วนใหญ่ต่างจากพันธะโคเวเลนต์ซึ่งแสดงว่าโลหะน่าจะยึดเหนี่ยวกันด้วยพันธะที่แตกต่างจากพันธะไอออนิกและพันธะโคเวเลนต์การที่อะตอมของโลหะมีค่าพลังงานไอออไนเซชันต่างการยึดเหนี่ยวระหว่างวาเลนอิเล็กตรอนกับโปรตอนในนิวเคลียสจึงน้อยให้เวเลนซ์อิเล็กตรอนของแต่ละอะตอมสามารถเคลื่อนที่ได้อย่างอิสระไปทั่วทั้งชิ้นโลหะและเกิดการยึดเหนี่ยวกับโปรตอนในนิวเคลียสทุกทิศทุกทางการยึดเหนี่ยวนี้เรียกว่าพันธะโลหะการเกิดพันธะโลหะแสดงได้ด้วยแบบจำลองทะเลอิเล็กตรอน
3.4.2 สมบัติของโลหะ
1.โลหะมีจุดหลอมเหลวและจุดเดือดสูง
2.โลหะมีผิวมันวาวและสามารถสะท้อนแสงได้
3.โลหะนำไฟฟ้าและความร้อนได้ดี นอกจากนี้โลหะยังสามารถตีให้ออกเป็นแผ่นและดึงให้เป็นเส้นด้าย
จากการที่สารประกอบไอออนิกสารโคเวเลนต์และโลหะมีสมบัติเฉพาะตัวมาว่าการที่ต่างกันจึงสามารถนำมาใช้ประโยชน์ในด้านต่างๆได้ตามความเหมาะสม เช่น
- แอมโมเนียมคลอไรด์และซิงค์คลอไรด์ เป็นสารประกอบไอออนิกที่สามารถนำไฟฟ้าได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ำจึงนำไปใช้เป็นสารอิเล็กโทรไลต์ในถ่านไฟฉาย
- พอลิไวนิลคลอไรด์หรือ PVC เป็นสารโคเวเลนต์ที่ไม่สามารถนำไฟฟ้าได้จึงเป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า
- ซิลิกอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่างตาข่ายที่มีจุดหลอมเหลวสูงและมีความแข็งแรงมากจึงนำไปใช้ทำเครื่องบด
- ทองแดงและอะลูมิเนียม เป็นโลหะที่นําไฟฟ้าได้ดีจึงนำไปใช้เป็นตัวนำไฟฟ้าอะลูมิเนียมและเหล็กเป็นโลหะที่นําความร้อนได้ดีจึงนำไปทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กระทะะ
สมัครสมาชิก:
ความคิดเห็น (Atom)
-
ข้อสอบ หน่วยการเรียนรู้ที่ 2 พันธะเคมี 1.จำนวนพันธะโคเวเลนต์ในโมเลกุล CH4 , SiCl4 , NaCl , NH3 เป็นกี่พันธะมีค่าเรียงตามลำดับ คือข้อใด ...
-
แบบทดสอบ หน่วยการเรียนรู้ที่ 1 อะตอมและตารางธาตุ 1. อะตอมประกอบไปด้วยโปรตอนและอิเล็กตรอนในจำนวนที่เท่า ๆ กัน คือ แบบจำลองอะตอมของใคร ...